Очний саркоїдоз

Очний саркоїдоз
Джерело: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4662043/
Анотація
Саркоїдоз є однією з основних причин запальних захворювань очей. Очний саркоїдоз може вражати будь-яку частину ока та його придаткову тканину й викликати увеїт, епісклерит/склерит, аномалії повік, кон’юнктивальну гранульому, нейропатію зорового нерва, збільшення сльозової залози та запалення орбіти. Глаукома й катаракта можуть бути ускладненнями самого запалення або побічними ефектами терапії. Офтальмологічні прояви можуть бути ізольованими або пов’язаними з ураженням інших органів. Пацієнти з очним саркоїдозом можуть мати широкий діапазон клінічних проявів і тяжкості. Для досягнення найкращих результатів лікування як очних, так і системних проявів потрібні мультидисциплінарні підходи.
Ключові слова: саркоїдоз, око, увеїт, сухість ока, нейропатія зорового нерва, запалення орбіти.
Саркоїдоз може вражати майже будь-яку структуру всередині або навколо ока. Крім того, першим розпізнаним клінічним проявом саркоїдозу часто є захворювання очей. Як офтальмологи, так і неофтальмологи повинні знати про різноманітні очні прояви саркоїдозу.
Епідеміологія
Ураження очей при саркоїдозі було відомо з початку 1900-х років і стало визнаним з середини 1900-х років.1 Варіативність діагностичних критеріїв ускладнює епідеміологічні дослідження саркоїдозу очей.
Поширеність ураження очей у різних дослідженнях коливається в широкому діапазоні від 13% (турецьке дослідження) до 79% (японське дослідження) пацієнтів із системним саркоїдозом.2-4 Ураження очей є симптомом приблизно у 20-30%.5,6 Увеїт був зареєстрований у 30-70%, а кон’юнктивальні вузли були виявлені в 40%.2 У пацієнтів із системним саркоїдозом саме у жінок (56%) частіше розвивається ураження очей порівняно з чоловіками (23%) (досліджено 121 пацієнта з саркоїдозом, підтвердженим біопсією).6
Як повідомляється, саркоїдоз може вражати дітей, і більшість із цих випадків починається у віці від 8 до 15 років.7 Однак у багатьох пацієнтів, у яких раніше був діагностований саркоїдоз із раннім початком, тепер визнають синдром Блау з мутаціями denovo.8 Віковий розподіл саркоїдозу очей у дорослих бімодальний. Два піки захворюваності – 20-30 років і 50-60 років.2 Середній вік при прояві увеїту становить 42 роки (діапазон 4-82).9 Афроамериканці з підтвердженим біопсією саркоїдозом мають вищу ймовірність розвитку ураження очей порівняно з представниками європеоїдної раси.10 Раса також може впливати на вік початку увеїту. Чорношкірі схильні до розвитку увеїту в середньому у віці 35-44 років, тоді як білі частіше мають увеїт у середньому віці 43-52 років.9,11
Саркоїдоз становив приблизно 1-3% педіатричних увеїтів у реферальних центрах12,13, тоді як було встановлено, що приблизно 10% увеїтів дорослих були пов’язані з саркоїдозом.14,15 Епідеміологічне дослідження на південному сході Сполучених Штатів показало, що саркоїдоз був причиною увеїту у 11% обстеженої популяції (385 пацієнтів: 67% кавказьких, 31% афроамериканців). Аналіз підгруп показав, що саркоїдоз становив 25% увеїтів серед афроамериканських пацієнтів.15
Більшість саркоїдозних увеїтів є двосторонніми й приблизно 90% є хронічними.9 Поширеність підтипу увеїту на основі анатомічної локалізації різниться в різних дослідженнях, частково через різну термінологію, що використовується. Dana та інші повідомили, що зі 112 очей із саркоїдозним увеїтом 28% були передніми, 38% були проміжними, 12% були задніми, а 22% були панувеїтом.9 Турецьке дослідження повідомило про 46% як проміжний, 15% як передній і 38% як панувеїт.16 Інше дослідження, проведене в Японії, описало 75% пацієнтів із іритом і 67% васкулітом сітківки.4
Частота саркоїдозу у пацієнтів з мультифокальним хоріоретинітом є різною через різні діагностичні критерії та обсяг досліджень у різних дослідженнях. Дослідження, проведене Abad та ін. за участю 37 пацієнтів із мультифокальним хоріоретинітом, продемонструвало поширеність (68%) доведеного за допомогою біопсії та передбачуваного саркоїдозу17, тоді як Ossewaarde-VanNorel та ін. повідомили про 39% показник.18 Слід зазначити, що 62% пацієнтів у першому дослідженні отримали КТ грудної клітини17, але лише 26% зробили в останньому.18
Випадок – контрольоване етіологічне дослідження саркоїдозу (ACCESS) – представило докази алельної варіації в локусі HLA-DRB1 як значного чинника, що сприяє розвитку саркоїдозу. Алель HLA-DRB1*0401 асоціювалась з ураженням очей як у чорношкірих, так і у білих (співвідношення шансів 3,49).19
Клінічні прояви саркоїдозу очей
Захворювання очей може бути початковим проявом у пацієнтів із саркоїдозом і може спричинити серйозне порушення зору. Ураження може характеризуватися гранулематозним запаленням, що здатне вражати будь-яку частину ока та його придатки. Приклади клінічних проявів очного саркоїдозу наведені в табл. 1. Найбільш поширеними очними проявами є увеїт, сухість очей і кон’юнктивальні вузлики.
Таблиця 1
Приклади клінічних проявів саркоїдозу очей
|
Очні структури |
Офтальмологічні прояви |
|
Повіки |
Гранульома повік, мадароз (випадання вій), поліоз (відбілювання вій), ентропіон, трихіаз, лагофтальм (якщо це пов’язано з лицевим паралічем) |
|
Кон’юнктива |
Кон’юнктивальні вузлики або гранульоми, кон’юнктивіт, симблефарон, рубці кон’юнктиви |
|
Епісклера/склера |
Епісклерит, склерит |
|
Рогівка |
Периферичний виразковий кератит, інтерстиціальний кератит, експозиційна кератопатія, смугова кератопатія |
|
Трабекулярна сітка та кут передньої камери |
Трабекулярна гранульома, периферичні передні синехії, очна гіпертензія, глаукома |
|
Райдужка |
Передній увеїт (ірит), вузлики/гранульоми райдужки, задні синехії, аномалії зіниці |
|
Кришталик |
Катаракта |
|
Parsplana/склисте тіло |
Проміжний увеїт |
|
Сітківка |
Ретиніт, васкуліт сітківки, макулярний набряк |
|
Судинна оболонка |
Хоріоідит, гранульома |
|
Зоровий нерв |
Папіліт, набряк зорового нерва (підвищення внутрішньочерепного тиску внаслідок нейросаркоїдозу), гранульома, нейропатія зорового нерва (компресійна або інфільтративна), атрофія зорового нерва |
|
Слізна залоза |
Гранульома, дакріоаденіт, сухий кератокон’юнктивіт (сухе око) |
|
Носо-сльозова дренажна система |
Затикання носо-сльозової протоки |
|
Екстраокулярні м’язи та інші орбітальні тканини |
Гранульома, косоокість, проптоз, компресія зорового нерва |
|
Внутрішньочерепні ураження із залученням зорових шляхів |
Зниження зору, дефекти поля зору, аномальна реакція зіниць, аномальний рух очей |
• Увеїт та аномалії очного дна
Увеїт – це термін, що використовується для опису запалення увеальних тканин, які складаються з райдужки, війкового тіла та судинної оболонки. Увеїт зазвичай вражає тканину або простір, що прилягає до судинної оболонки ока, наприклад передню камеру, склисте тіло або сітківку. Увеїт найчастіше класифікують за анатомічною локалізацією запалення за допомогою біомікроскопії на щілинній лампі та дослідження очного дна. Увеїт, пов’язаний із саркоїдозом, може проявлятися переднім, проміжним, заднім або панувеїтом. Найбільш загальновизнана класифікація увеїту, класифікація та термінологія опубліковані робочою групою стандартизації номенклатури увеїту (SUN).20
Насправді саркоїдоз добре відомий як причина гранульоматозного запалення. Когось можна легко заплутати багатьма авторами, які стверджують, що саркоїдозний увеїт може бути представлений як «негранульоматозний» або «гранульоматозний» увеїт. Ці клінічні патологічні терміни по суті є неправильними назвами, оскільки вони не відображають фактичних гістопатологічних досліджень. «Гранульоматозний» увеїт використовують, коли спостерігається принаймні одна з таких клінічних ознак: 1) великі рогівкові преципітати баранячого жиру (КП) (накопичення запальних лейкоцитів, що осідають на ендотелії рогівки), 2) вузлики райдужної оболонки або трабекулярної сітки, або 3) хоріоїдальна гранульома. Нерідко типові випадки саркоїдного увеїту супроводжуються принаймні одним із цих знахідок. Однак ці ознаки можуть спостерігатися не у всіх випадках, особливо у випадках з раннім початком, ті, у кого менш серйозне запалення, або ті, які пройшли успішне лікування. З іншого боку, ці ознаки не є специфічними для саркоїдозного увеїту, оскільки їх можна помітити при увеїті, пов’язаному з іншими причинами, такими як інфекції. Дослідження 112 очей із саркоїдозним увеїтом виявило 81% із гранульоматозним малюнком.9
Запалення передньої камери є, мабуть, найпоширенішою ознакою саркоїдозного увеїту. В одному дослідженні він був виявлений у 42 (91%) із 46 пацієнтів із підтвердженим біопсією саркоїдозним увеїтом.1 З цих 42 пацієнтів у 16 (38%) було запалення лише в передній камері, без залучення заднього сегмента.1 Типові клінічні прояви у пацієнтів із гострим запаленням передньої камери можуть включати почервоніння, погіршення зору, біль в очах і світлобоязнь. Ступінь запалення може варіювати від легкого до дуже важкого. Однак розвиток гіпопіону (гною в передній камері) малоймовірний.21 Біль може бути спричинений спазмом війок або підвищеним внутрішньоочним тиском (ВОТ). Підвищення ВОТ може бути вторинним у зв’язку з обструкцією трабекулярної сітки великою кількістю запальних лейкоцитів, вузликами трабекулярної сітки та запаленням або периферичними передніми синехіями (прилипання периферичної райдужної оболонки до периферичної рогівки, що перешкоджає відтоку води через трабекулярну сітку в уражену ділянку ). У випадках помірного та важкого запалення можуть утворюватися задні синехії (прилипання райдужної оболонки до передньої капсули кришталика), що спричиняє неправильну та слабко розширену зіницю, яка може перешкоджати детальному огляду заднього сегмента ока. Вузли райдужної оболонки зазвичай пов’язані з помірним або важким запаленням. Без відповідного лікування, важкий передній увеїт може призвести до деформації переднього сегмента та сприяти розвитку катаракти. Однак помірний саркоїдозний увеїт також може проявлятися приховано й пацієнти можуть бути безсимптомними. Діагноз можна виявити лише під час скринінгу або планового очного огляду. Раннє виявлення має вирішальне значення для потенційного запобігання наслідкам хронічного запалення.
Проміжний увеїт також є поширеним проявом очного саркоїдозу. Пацієнти можуть скаржитися на плавання та/або розмитість зору. Помутніння склистого тіла та кістозний макулярний набряк (КМЕ) є основними причинами зниження зору у пацієнтів із проміжним увеїтом. Ексудат ParsPlana та скупчення лейкоцитів і склистого тіла на поверхні сітківки під час огляду можна схарактеризувати як снігові кучугури та снігові кулі (також названі ниткою перлин). Неоваскуляризація диска зорового нерва та периферичної сітківки також може ускладнити ураження периферичної сітківки22 та призвести до крововиливу у склисте тіло в меншості випадків.
При саркоїдозному задньому увеїті ураження сітківки зазвичай супроводжують запалення хоріоїдеї; однак ураження сітківки або судинної оболонки може бути ізольованим (рис. 1). Заднє ураження, як правило, є двостороннім, але може бути значною мірою асиметричним. Хоріоїдальна гранульома(и) може бути уніфокальною або мультифокальною та може варіюватися за розміром від маленького (вузлики Далена-Фукса або саркоїдні плями) до великого (може симулювати пухлину хоріоїдеї).23,24 Периферичні гранульоми навряд чи викликають порушення зору, але центральні ураження можуть призвести до серйозних порушень зору. У таких ураженнях може розвинутися хоріоїдальна неоваскуляризація.25 Мультифокальний хоріоїдит, пов’язаний із саркоїдозом, може мати ознаки очного дна, дуже подібні до тих, що спостерігаються при хоріоретинопатії пташиної рани.26 Ексудативне відшарування сітківки рідко спостерігається у пацієнтів із саркоїдозом ока, особливо з великими хоріоретинальними гранульомами. Ліковані або неактивні ураження можуть бути помітні як мультифокальні периферичні невеликі перфоровані хоріоретинальні рубці, подібні до тих, що спостерігаються при ідіопатичному мультифокальному хоріоїдиті. Зміни пігментного епітелію сітківки спостерігаються в багатьох випадках, але зазвичай не викликають втрати зору.22 Проте значне ураження заднього полюса може спричинити серйозну постійну інвалідність зору (рис. 2).
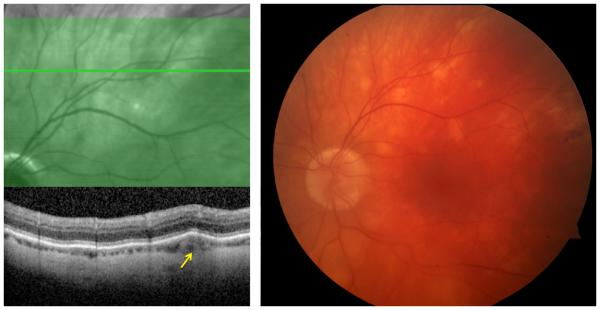
Рис. 1. (Праворуч) Кольорова фотографія очного дна 59-річного пацієнта чоловічої статі з мультифокальним хороїдитом, вторинним стосовно саркоїдозу, демонструє множинні круглі кремоподібні субретинальні ураження в надскроневому квадранті лівого ока; (ліворуч) дослідження оптичної когерентної томографії через ураження показало, що ураження в першу чергу охоплює судинну оболонку (стрілка)
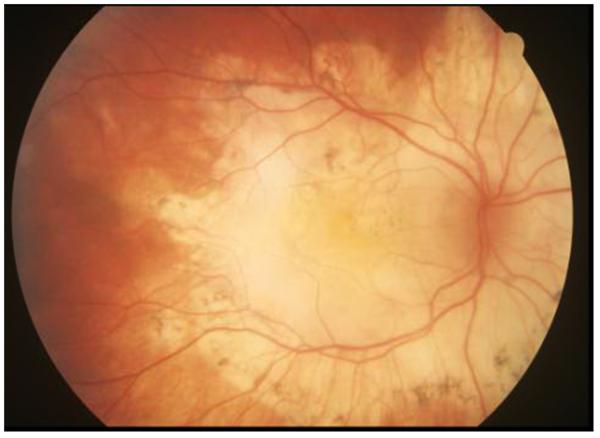
Рис. 2. Кольорова фотографія очного дна 56-річного пацієнта чоловічої статі з великою хоріоретинальною атрофією та вторинним рубцем внаслідок тривалого ураження ока саркоїдозом
Периваскулярна оболонка є загальним проявом васкуліту сітківки, пов’язаного з саркоїдозом ока. Характерний середньопериферичний перифлебіт. При важких формах з розсіяними білувато-жовтими периваскулярними ексудатами сітківки вздовж вен сітківки периваскулярні ексудати описуються як «свічкові воскові краплі».24 Як правило, перифлебіт при саркоїдозі очей не пов’язаний із значною оклюзією судин. Однак повідомлялося про оклюзійні захворювання судин сітківки, такі як оклюзія гілок і центральної вени сітківки. Інтраретинальні крововиливи та неоваскуляризація сітківки або диска зорового нерва з подальшим крововиливом у склисте тіло можуть ускладнити ретинальний васкуліт, вторинний стосовно саркоїдозу.
CME є поширеною причиною втрати зору у пацієнтів із саркоїдозним увеїтом. Він може супроводжувати важке активне запалення або васкуліт сітківки в задньому полюсі. Зазвичай він реагує на терапію кортикостероїдами. Також може відбуватися утворення епіретинальної мембрани.
Повідомлялося, що в одному дослідженні частота ураження центральної нервової системи збільшується з 2% до 37%, коли при саркоїдозі ока спостерігаються аномалії очного дна.24 Однак інше дослідження не виявило такого зв’язку.22
• Ураження зорового нерва та нейроофтальмологічні прояви
Нейросаркоїдоз іноді називають «великим імітатором», оскільки він може викликати неспецифічні та варіабельні симптоми, що імітують багато інших станів. Симптоми пов’язані з місцем утворення гранульоми та відповідними наслідками запалення. Ці симптоми можуть включати зниження зору або дефекти поля зору внаслідок ураження зорового нерва та його зорового шляху, набряк зорового нерва (див. нижче) внаслідок підвищення внутрішньочерепного тиску, аномальний рух очей, аномалії зіниці, зорові галюцинації, енцефалопатію, васкулопатію, периферичну нейропатію, міопатію, судоми, асептичний менінгіт, гідроцефалію, ураження спинного мозку та психіатричні симптоми.27
Краніальна нейропатія є найбільш частим проявом нейросаркоїдозу. Найчастіше уражаються зоровий і лицьовий нерви.28 Ураження зорового нерва може бути помітним у вигляді гранульом або вузликів зорового нерва, набряку диска зорового нерва або атрофії зорового нерва. Набряк диска зорового нерва, окрім вторинного підвищення внутрішньочерепного тиску внаслідок ураження, що займає простір, або гідроцефалії, може бути пов’язаний або з важким заднім увеїтом або перифлебітом, або з прямим ураженням диска зорового нерва, нерва чи оболонки нерва гранульоматозною тканиною.29 Необоротне порушення гостроти зору спостерігається у більш ніж половини пацієнтів із прямим ураженням зорового нерва.30 Класичним проявом є парез обличчя. Вважалося, що це пов’язано або із запаленням привушної залози в результаті менінгітичної реакції, або з прямим її стисненням.30 Парез лицьового нерва нижнього мотонейрона може спричинити іпсилатеральний поганий тонус повік та їх закриття, що може призвести до оголеної кератопатії, епіфори й ектропіону. Серйозні аномалії поверхні можуть прогресувати до виразок рогівки з постійною сліпотою.
При нейросаркоїдозі можуть спостерігатися набуті аномальні рухи очей, такі як ністагм.31 При саркоїдозі з ураженням центральної нервової системи повідомлялося про аномалії зіниць, такі як відносний дефект зіниці та дисоціація, що майже сягає світла, а також зорові галюцинації.32
• Захворювання повік та очної поверхні
Дерматологічні прояви саркоїдозу добре відомі. Може спостерігатися ураження повік частково або на всю товщину. Периорбітальний еритематозний набряк повік може бути єдиною ознакою очного саркоїдозу.33,34 Еритематозні утворення повік можуть варіюватися за розміром від невеликих папул35 до великого утворення, що може імітувати пухлини повік або шкірні рубці.36 Collins та інші повідомили про випадок 50-річної жінки з системним саркоїдозом, включаючи легеневі, дерматологічні та суглобові симптоми. У пацієнта були хронічні вузлики на повіках, які згодом спричинили подразнення очей і деформацію повік із виїмками на шкірі слизової оболонки. У неї були значні рубці на задній пластинці, що спричинило ентропіон і трихіаз. Пацієнтці була виконана клиноподібна резекція повної товщини для лікування неправильного положення вій. Патогістологічне дослідження показало неказеозну гранульому повік повної товщини.37 Про подібний випадок повідомили Мойн і його колеги у 43-річного афроамериканця. У пацієнта спотворена архітектоніка повік з мадарозом, виразним дрібним ракурсом і симблефароном. Біопсія повік, кон’юнктиви та шкіри обличчя продемонструвала неказеозне гранульоматозне запалення. Велике руйнування повіки частково лікували кортикостероїдами та метотрексатом перед операцією з реконструкції.38 Рідко гранульоматозне запалення може вибірково включати невеликі структури повік, такі як м’яз Мюллера, й таке ураження може спричинити втягнення повік, що набагато частіше спостерігається у пацієнтів із тиреоїдною орбітопатією.39
Ураження кон’юнктиви є поширеним явищем, але його можна не помітити, оскільки більшість уражень кон’юнктиви протікають безсимптомно. Найбільш типові кон’юнктивальні вузлики спостерігаються на кон’юнктиві ока; однак вони також можуть розташовуватися в бульбарних або перілімбальних зонах.40 Ранні ураження можуть проявлятися у вигляді множинних білих дискретних бульбарних відкладень на кон’юнктиві.41 Деякі пацієнти можуть мати значне почервоніння та подразнення, що проявляється як гострий фолікулярний кон’юнктивіт.42,43 Також повідомлялося про випадки хронічного рубцевого кон’юнктивіту з прогресивним рубцюванням і симблефароном.44,45 Велика кон’юнктивальна гранульома може симулювати кон’юнктивальні пухлини.46
Склерит рідко асоціюється з саркоїдозом, але саркоїдоз слід враховувати при диференціальній діагностиці склериту. Склерит, асоційований із саркоїдозом, може проявлятися як передній дифузний47, передній вузликовий47-49, або задній склерит.50 Усі зареєстровані випадки стосувалися жінок віком від 53 до 64 років,47-49 які були в середньому старшими за більшість пацієнтів із саркоїдозним увеїтом, за винятком одного пацієнта (42-річного чоловіка) із заднім склеритом, який також мав кільцеподібний увеїт та циліохориоїдальний випіт.50 Склерит, асоційований із саркоїдозом, швидше за все, не є некротичним і, як правило, добре реагує на пероральні кортикостероїди. Клініко-патологічне дослідження 55 пацієнтів, у яких був діагностований некротичний склерит, показало, що лише один пацієнт (1,8%) мав саркоїдоз. Хоча пацієнт клінічно представлявся як некротичний склерит, біопсія продемонструвала дискретне ненекротизуюче гранульоматозне запалення.51
Рогівка також може бути вражена очним саркоїдозом. Найпоширенішим ураженням рогівки є поверхневий точковий кератит, вторинний до сухого кератокон’юнктивіту (KCS; сухість очей). Пацієнти з хронічним запаленням можуть мати периферичні помутніння внаслідок відкладень кальцію на субепітеліальному шарі Боумена, або так звану смужкову кератопатію.1 Про інтерстиціальний кератит також повідомлялося як про ознаку очного саркоїдозу разом з ознаками заднього увеїту та набряку диска зорового нерва. Згодом у пацієнта був діагностований саркоїдоз за допомогою трансбронхіальної біопсії через два роки.52 Периферичний виразковий кератит, що призводить до перфорації рогівки, також був описаний у 42-річної жінки в одному звіті.53
• Сльозова система та сухий кератокон’юнктивіт (KCS)
Сльозова залоза є найбільш поширеним органом орбіти, що уражається саркоїдозом. Гістопатологічні дослідження орбітального саркоїдозу, підтвердженого біопсією, виявили ураження основної сльозової залози у 42-63%.54-56 Пацієнти з ураженням сльозових залоз можуть мати або не мати симптомів. Якщо є значне збільшення сльозової залози, вони можуть проявлятися пальпованим утворенням або іншими симптомами внаслідок масових ефектів. Характерними ознаками комп’ютерної томографії (КТ) є дифузне збільшення залози з однорідним її збільшенням.54
KCS давно визнано поширеним наслідком саркоїдозу.57 Вважається, що синдром сухого ока при саркоїдозі пов’язаний головним чином із запаленням/інфільтрацією сльозової залози, що призводить до зниження утворення водянистої сльози. Більшість досліджень повідомляли про аномальні результати візуалізації та біопсії головної сльозової залози, але, наскільки нам відомо, жодне не згадувало про ураження додаткових сльозових залоз. Однак повідомлялося про ураження шкіри повік на всю товщину.37 Фізіологічно основні сльозові залози, розташовані в передньо-латеральній частині орбіти, відповідають головним чином за рефлекторну секрецію сліз, тоді як малі додаткові сльозові залози в повіці та кон’юнктиві виробляють більшу частину базальної сльози. Ці знання можуть означати, що як головні, так і додаткові сльозові залози можуть бути уражені у тих, хто має сильну сухість очей, пов’язану з саркоїдозом. KCS може викликати подразнення, сльозотечу, епітеліопатію рогівки, стирання рогівки, інфекцію та постійні рубці на рогівці.
Сльоза дренується через puncta, канальці, носо-сльозовий мішок і протоку в носовий хід. Гранульоматозне запалення внаслідок саркоїдозу може безпосередньо впливати на дренажну систему сльозової системи, спричиняючи затикання сльозової системи та спричиняючи симптоматичну епіфору (надмірну сльозотечу).58,59
• Ураження орбіти
Окрім сльозової залози, саркоїдоз також може залучати інші орбітальні структури, включаючи орбітальний жир, екстраокулярні м’язи та оболонку зорового нерва.54 Гістопатологічні дослідження показали, що основними скаргами пацієнтів із орбітальним саркоїдозом, які потребують орбітальної біопсії, є пальпована пухлина та набряк повік.54-56 Інші симптоми включали птоз, зміщення яйцеклітини, проптоз, почервоніння, біль, втрату зору, сльозотечу та диплопію56. Вік коливався від 18 до 83 років, середній вік приблизно 45-55 років. Більшість пацієнтів були жінки. Одночасний системний саркоїдоз був зареєстрований у 34-50% підтвердженого біопсією орбітального саркоїдозу.54,56 Ураження були добре обмежені у 85-90%, з 10-15% дифузних або інфільтративних моделей. Ураження були солідними, але рідко кістозними.56 Більшість уражень розташовані в передній орбіті, особливо передньо-нижній.55 Утворення орбіти, вторинне стосовно саркоїдозу, може спричинити оклюзію центральної артерії сітківки, що призводить до постійної сліпоти.60
• Глаукома та катаракта
Підвищений ВОТ часто зустрічається у пацієнтів із саркоїдозним увеїтом. Ретроспективне дослідження 1986 року повідомило про високу частоту серйозної втрати зору (зір 20/200 або гірше) у 8 з 11 пацієнтів з одночасним саркоїдозним увеїтом і глаукомою.61 Очна гіпертензія та глаукома можуть бути результатом дисфункції трабекулярної сітки через набряк або обструкцію запальними клітинами. Важке або хронічне запалення передньої камери може спричинити закритокутову глаукому внаслідок утворення периферичних передніх синехій. Японське дослідження виявило високу частоту аномальних гоніоскопічних знахідок (61% трабекулярних вузликів і 55% наметоподібних периферичних передніх синехій) серед 159 пацієнтів із системним саркоїдозом.4 Пацієнти з увеїтною глаукомою мають значний ризик невдачі хірургічного втручання, коли потрібна процедура фільтрації.62 Підвищення ВОТ також може бути пов’язане з впливом орбітальної маси або побічними ефектами терапії кортикостероїдами.
Утворення катаракти також часто зустрічається у пацієнтів із саркоїдозним увеїтом і призводить до втрати зору. Будь-яка форма кортикостероїдної терапії, включаючи місцеві, регіональні або системні кортикостероїди, може спричинити катаракту та очну гіпертензію.
Діагностика саркоїдозу очей
Саркоїдоз є одним із кількох станів, що можуть одночасно охоплювати кілька тканин ока з різними проявами. Наприклад, у пацієнтів може спостерігатися гострий передній увеїт із збільшенням сльозової залози, двобічний мультифокальний хоріоїдит із кон’юнктивальними вузликами або периферичний виразковий кератит із запаленням очниці. Саркоїдоз має бути особливо важливим при диференціальній діагностиці у пацієнтів із залученням кількох тканин ока.
Золотим стандартом діагностики саркоїдозу є біопсія тканини. Найчастіше беруть зразки біопсії з легень, лімфатичних вузлів, шкіри, кон’юнктиви, сльозових залоз або орбітальних тканин. Однак підозрювані ураження можуть бути важкодоступними, й біопсія може бути не бажаним діагностичним вибором з точки зору пацієнта. Найбільш часто уражаються легені та пригрудні лімфатичні вузли. Таким чином, візуалізаційні дослідження, включаючи рентген грудної клітки, комп’ютерну томографію грудної клітки та інколи галієву сцинтиграфію, можуть допомогти встановити діагноз. Деякі пацієнти з саркоїдозом можуть мати підвищені рівні кальцію, ангіотензинперетворювального ферменту (АПФ) та/або лізоциму в сироватці крові.
Діагностичні критерії очного саркоїдозу відрізняються у різних експертів. У 2009 році на першому міжнародному семінарі з саркоїдозу очей (IWOS) були опубліковані міжнародні критерії діагностики саркоїдозу очей, що мали на меті універсальне використання.63 Члени IWOS визначили 7 клінічних ознак, що вказують на саркоїдоз очей, 5 лабораторних досліджень при підозрі на саркоїдоз очей і 4 діагностичні терміни для саркоїдозу очей (табл. 2).
Таблиця 2
Резюме з Міжнародних критеріїв діагностики очного саркоїдозу
|
Очні ознаки, що вказують на саркоїдоз очей |
|
|
1. Пласкі рогівкові преципітати та/або вузлики райдужки |
|
|
2. Трабекулярні сітчасті вузлики та/або наметосхожі периферичні передні синехії |
|
|
3. Сніжки або нитки перлів у склистому тілі |
|
|
4. Активні або неактивні множинні хоріоретинальні периферичні ураження |
|
|
5. Вузликовий та/або сегментарний перифлебіт та/або макроаневризми в запаленому оці |
|
|
6. Вузлик(и)/гранульома(и) диска зорового нерва та/або одиничний хоріоїдальний вузлик |
|
|
7. Двостороннє залучення |
|
|
Лабораторні дослідження у пацієнтів з підозрою на саркоїдоз очей |
|
|
1. Негативна туберкулінова проба у пацієнта, вакцинованого БЦЖ, або з попередньою позитивною шкірною пробою PPD (або Манту) |
|
|
2. Підвищений рівень ангіотензинперетворювального ферменту (АПФ) та/або лізоциму в сироватці крові |
|
|
3. Рентгенограма грудної клітини на двосторонню симетричну аденопатію грудної клітини |
|
|
4. Аномальні тести печінкових ферментів (будь-які 2 з лужної фосфатази, аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ), лактатдегідрогенази (ЛДГ) або гамма-глутамілтрансферази (ГГТ)) |
|
|
5. Комп’ютерна томографія грудної клітки у хворих з негативною рентгенограмою грудної клітки |
|
|
Діагностичні критерії та термінологія саркоїдозу очей |
|
|
Виразний очний саркоїдоз |
Підтверджено біопсією із сумісним увеїтом |
|
Передбачуваний саркоїдоз ока |
Біопсія не проводиться; двостороння гілярна аденопатія (BHL) із сумісним увеїтом |
|
Ймовірний очний саркоїдоз |
Біопсія не виконана, BHL не виявлено; наявність 3 сугестивних очних симптомів і 2 позитивних вищезазначених лабораторних тестів |
|
Можливий очний саркоїдоз |
Біопсія негативна; наявність 4 сугестивних очних симптомів і 2 позитивних вищезазначених лабораторних тестів |
Адаптовано Herbort CP, Rao NA, Mochizuki M, члени наукового комітету першого міжнародного семінару з очного саркоїдозу. Міжнародні критерії діагностики очного саркоїдозу: результати першого міжнародного семінару з очного саркоїдозу (IWOS). OculImmunolInflamm. 2009;17(3):160-169; з дозволу.
Перелічені клінічні ознаки корисні для діагностики саркоїдозного увеїту. Однак IWOS не обговорював критерії діагностики ураження придатків ока, що в основному діагностували на основі гістопатологічних досліджень доступних уражень. У нашій практиці ми зазвичай починаємо з рентгена грудної клітки та залишаємо КТ грудної клітки для дуже підозрілих пацієнтів або для тих, для яких діагноз може змінити терапію. Через кількість радіації ми рідше замовляємо КТ грудної клітини молодшим пацієнтам. Підвищення рівня кальцію, АПФ або лізоциму в сироватці крові зазвичай не є ані чутливим, ані специфічним для діагностики.
Біопсія кон’юнктиви є простою та корисною процедурою, коли у пацієнтів є кон’юнктивальні вузлики або помітні фолікули. Ретельне обстеження може виявити ці висновки. Існують великі розбіжності щодо результативності випадкової біопсії кон’юнктиви у тих, хто не має видимих уражень кон’юнктиви. У різних дослідженнях частота позитивних результатів випадкової біопсії коливалася від 20 до 71% у пацієнтів з позитивною біопсією з інших локалізацій і від 1 до 28% у пацієнтів з клінічною підозрою на саркоїдоз без гістологічного підтвердження.1,64-66 Nichols та ін. повідомили про 55% позитивних результатів біопсії кон’юнктиви у пацієнтів із підтвердженим біопсією саркоїдозом з інших тканин, але лише про 1% позитивних результатів у пацієнтів із негативною системною біопсією. У цьому дослідженні смужку кон’юнктивальної тканини розміром принаймні 3 на 10 мм кожна видаляли з нижнього тупикового мішка обох очей. Автори не виявили зв’язку між випадками переднього увеїту та позитивною біопсією кон’юнктиви.64 Наявність кон’юнктивальних фолікулів може дещо збільшити ймовірність позитивного результату біопсії. Cricketal продемонстрували 20% позитивних результатів біопсії кон’юнктиви при саркоїдозі, підтвердженому біопсією, і цей показник збільшився до 37% у тих, хто мав кон’юнктивальні фолікули.1 У нашій практиці ми зберігаємо біопсію кон’юнктиви лише для тих, у кого під час обстеження є видимі кон’юнктивальні вузлики.
Кілька неінвазивних діагностичних методів візуалізації були вивчені у пацієнтів з очним саркоїдозом. Конфокальна мікроскопія invivo кон’юнктиви була успішно використана для визначення присутності багатоядерних гігантських клітин у пацієнтів із саркоїдозними кон’юнктивальними вузликами зі 100% специфічністю та 50% чутливістю.67 Процедура потребує технічних навичок і може знадобитися прилад із високою роздільною здатністю та здатністю глибокого проникнення для підвищення чутливості тесту. Rose-Nussbaumer та інші нещодавно повідомили, що спектрально-доменна оптична когерентна томографія (ОКТ) переднього сегмента може диференціювати переважно мононуклеарну структуру клітин передньої камери при активному передньому увеїті, пов’язаному з саркоїдозом або запальним захворюванням кишківника, від переважно поліморфоядерної картини HLA-B27- супутній увеїт.68 Güngör та інші виявили, що пацієнти з латентним саркоїдозним заднім увеїтом можуть мати менші вимірювання товщини хоріоідеї порівняно з нормальною контрольною групою за допомогою ОКТ із покращеним глибинним зображенням.69
Наша група раніше вивчала мікроматричний аналіз експресії генів у периферичній крові, легенях і лімфатичних вузлах і виявила, що у пацієнтів із саркоїдозом (з або без увеїту) спостерігалося значне підвищення STAT1 і STAT1-регульованих хемокінів порівняно з нормальною контрольною групою. STAT1 є чинником транскрипції. Він може бути активований інтерферонами, що сприяють утворенню гранульом й іноді викликають гранульоматозні побічні реакції.70 Патерн підвищеної регуляції STAT1 не спостерігався у пацієнтів з анкілозуючим спондилітом (з увеїтом або без нього).71 Подальше дослідження експресії генів на тканинах гранульоми кон’юнктиви показало, що активована форма STAT1 частіше виявлялася у пацієнтів із саркоїдозом; однак активність генів, регульованих STAT1, може бути не специфічною лише для саркоїдозу, оскільки STAT1 також може проявлятися на інших гранулематозних захворюваннях кон’юнктиви.72 Зовсім недавно ми проаналізували модель експресії генів у сльозовій залозі або орбітальній жировій тканині, враженій саркоїдозом.73 Це дослідження підтвердило підвищену експресію STAT1 і показало, що схожі транскрипти підвищені в крові та твердих тканинах пацієнтів із саркоїдозом.73
Лікування саркоїдозу очей
Основними цілями лікування саркоїдозу очей є відновлення зору та запобігання ускладненням, пов’язаним із запаленням. Кортикостероїдна терапія, включаючи місцеве, регіональне та системне застосування, є основою лікування. Інші імуномодулятори можуть знадобитися деяким пацієнтам, які залежні, не реагують або не переносять лікування кортикостероїдами.
• Лікування саркоїдного увеїту
- Топічні кортикостероїди
Найпоширенішим місцевим кортикостероїдом при передньому увеїті є преднізолону ацетат. Його дозу можна титрувати залежно від ступеня запалення передньої камери від одного разу на день до щогодини. Відносно новий препарат, дифлупреднат, як правило, сильніший. Діфлупреднат 0,05% 4 рази на день може бути принаймні таким же ефективним, як преднізолону ацетат 1% 8 разів на день для лікування переднього увеїту.74 Їхні побічні ефекти є дозозалежними, з найбільшою занепокоєністю щодо підвищення ВОТ і прогресування катаракти.
Місцеві кортикостероїдні краплі використовуються в основному для лікування запалення передньої камери, але зазвичай їх недостатньо для контролю запалення заднього сегмента. Однак це може бути ефективним для лікування CME, пов’язаного з квітковим переднім увеїтом.
- Місцеві циклоплегіки
Циклоплегічні очні краплі допомагають полегшити біль від спазму війок і порушити або запобігти заднім синехіям, що часто зустрічаються у пацієнтів із помірним і важким запаленням передньої камери. Ліки короткої дії, такі як циклопентолат 1%, як правило, використовуються в гострому випадку, а препарати більш тривалої дії, такі як атропін 1%, можна призначати пацієнтам із хронічним або важким запаленням передньої камери.
- Регіонарні ін’єкції кортикостероїдів та імплантати
Регіонарні ін’єкції та імплантації кортикостероїдів можна розглядати при увеїті, пов’язаному з ураженням заднього сегмента, або коли пацієнт погано реагує чи не відповідає на часті місцеві кортикостероїди. Депо-ін’єкції можна вводити периокулярно або інтравітреально.
Періокулярні ін’єкції можна виконувати як черезшкірним, так і транскон’юнктивальним шляхом, а також верхнім або нижнім доступом. У нашій практиці орбітальна ін’єкція зазвичай виконується через нижньолатеральну шкіру повік. Найбільш часто використовуваним препаратом є тріамцинолону ацетонід 20-40 мг. Прикладами інших альтернатив є бетаметазон і метилпреднізолон, що мають меншу тривалість ефекту порівняно з тріамцинолону ацетонідом. Ін’єкцію можна повторити через 4-6 тижнів після початкової терапії.
Можна вводити інтравітреально тріамцинолону ацетоніду (1-4 мг), особливо якщо периокулярні ін’єкції недостатньо контролюють запалення. Ефект може тривати 3-6 місяців після кожної ін’єкції. За пацієнтами необхідно ретельно спостерігати щодо підвищення ВОТ. Процедуру можна проводити в клініці під місцевою або субкон’юнктивальною анестезією.
Біорозкладаний внутрішньоочний імплантат, що містить 700 мікрограмів дексаметазону, що вводиться через аплікатор 22-го калібру, був схвалений для лікування увеїту заднього сегмента ока. Дослідження його ефективності та безпеки для стійкого увеїтного CME показало, що один імплантат дексаметазону був ефективним для покращення зору та макулярного набряку у більшості пацієнтів. Однак рецидив CME може спостерігатися приблизно у 65% пацієнтів через 6 місяців.75 Дослідження, у якому порівнювали інтравітреальні ін’єкції тріамцинолону з імплантатами дексаметазону при ХВМ, вторинному до оклюзії вени сітківки, продемонструвало схожі результати та схожу частоту побічних ефектів.76
Імплантат флуоцинолонуацетоніду з уповільненим вивільненням був схвалений у США для лікування хронічного неінфекційного заднього увеїту. Імплантат вставляється хірургічним шляхом у порожнину склистого тіла через склеральний розріз і може вивільняти ліки протягом середнього періоду 30 місяців. Він ефективний для контролю запалення в більшості імплантованих очей77, але він пов’язаний з високим рівнем ускладнень, особливо підвищеним ВОТ і катарактогенезом. Приблизно 37% імплантованих очей потребували хірургічного лікування глаукоми в 3-річному дослідженні.78 Економічне дослідження показало, що імплантат флуоцинолону був досить економічно ефективним порівняно з системними імунодепресантами у пацієнтів з одностороннім захворюванням, але не для тих, хто потребує двосторонніх імплантатів.79
- Системні кортикостероїди
Системні кортикостероїди застосовуються у пацієнтів із тяжким двостороннім увеїтом, коли місцева та/або місцева терапія недостатня для контролю запалення або коли системне захворювання також потребує терапії. Системна терапія кортикостероїдами, як правило, швидко досягає ефективності, але високі дози, такі як 60 мг преднізону на добу, слід використовувати протягом обмеженого часу, щоб уникнути як очних, так і системних побічних ефектів. Преднізон є найбільш часто вживаним пероральним кортикостероїдом у Сполучених Штатах. Зазвичай спочатку призначають 1-1,5 мг/кг/день і поступово знижують, щоб уникнути рецидиву. Короткочасне внутрішньовенне введення метилпреднізолону іноді призначається пацієнтам з ураженням сітківки або зорового нерва, що загрожує зору, з подальшим пероральним прийманням преднізону.
- Системні імунодепресанти
Системні імунодепресанти показані пацієнтам із залежністю від кортикостероїдів або їх непереносністю. Низька доза преднізону, наприклад 5 мг на день, може бути кращою, ніж імунодепресант. У деяких випадках пацієнти могли вже отримати системний імунодепресант для контролю системних проявів саркоїдозу. Антиметаболіти80,81 та інгібітори кальциневрину82,83 були вивчені для лікування запалення очей, пов’язаного з саркоїдозом. Приклади та дозування системних імуносупресивних препаратів, що можна використовувати для лікування неінфекційного увеїту, наведені в табл. 3.84 Найбільш часто використовуваними препаратами для лікування хронічного запалення очей, включаючи очний саркоїдоз, є метотрексат85, мікофенолатмофетил86, азатіоприн87 і циклоспорин.88
Таблиця 3
Приклади стероїдзберігаючих системних імунодепресантів, що можна використовувати для лікування очного саркоїдозу
|
Ліки |
Доза |
Очікуваний початок дії |
|
Антиметаболіти |
||
|
Метотрексат |
7,5-25 мг/тиждень перорально, одноразово або внутрішньом’язово |
2-12 тижнів |
|
Мікофенолатумофетилу |
500-1500 мг внутрішньо двічі на день |
2-12 тижнів |
|
Азатіоприн |
1-4 мг/кг/добу перорально щодня |
4-12 тижнів |
|
Інгібітори кальциневрину |
||
|
Циклоспорин |
2,5-10 мг/кг/день перорально двічі на день |
2-6 тижнів |
|
Такролімус |
0,15-0,30 мг/кг/добу перорально |
2-6 тижнів |
IM = внутрішньом’язово; PO = per os; SQ = підшкірно
Адаптовано з Jabs DA, Rosenbaum JT, Foster CS, Holland GN, Jaffe GJ, Louie JS, Nussenblatt RB, Stiehm ER, Tessler H, VanGelder RN, Whitcup SM, Yocum D. Рекомендації щодо використання імуносупресивних препаратів у пацієнтів із захворюваннями очей.
Запальні захворювання: рекомендації експертної групи. Am J Ophthalmol. 2000;130(4):492-513; з дозволу.
- Біологічні агенти
Біологічні препарати є відносно новим методом лікування рефрактерного неінфекційного увеїту. Знання щодо очних показань в основному ґрунтуються на звітах про випадки та серії з меншістю доказів кількох нерандомізованих досліджень та одного рандомізованого дослідження з подвійною маскою.89 На сьогодні досліджені біологічні агенти для лікування увеїту, пов’язаного з саркоїдозом – це інгібітори чинника некрозу пухлин (TNF)-α, включаючи інфліксимаб, адалімумаб, етанерцепт і голімумаб.
У проспективному дослідженні повідомляється, що інфліксимаб є ефективним імуносупресивним засобом у більшості пацієнтів із рефрактерним увеїтом, пов’язаним із кількома причинами.90 Однак обмежені дані показали неоднозначні результати щодо його ефективності для контролю запалення очей, зокрема, при саркоїдному увеїті. Suhler та ін. проспективно включили 31 пацієнта з рефрактерним увеїтом до терапії інфліксимабом як супутнім імунодепресантом. У трьох із 31 пацієнта був діагностований саркоїдний панувєїт. У всіх 3 пацієнтів гострота зору покращилася після терапії інфліксимабом, але жоден із них не продемонстрував здатності повністю контролювати запалення або зменшити дози супутнього преднізону та імуносупресивної терапії вдвічі.90,91 Навпаки, у всіх 4 пацієнтів із саркоїдозним увеїтом з різних серій (292, 193 та 194) спостерігалося зникнення запалення ока через кілька тижнів після терапії інфліксимабом, але потрібне продовження інфузій інфліксимабу кожні 4-8 тижнів для запобігання рецидиву.
Erckens і його колеги вивчали застосування адалімумабу як допоміжної терапії на 41 оці 26 пацієнтів із рефрактерним заднім саркоїдозом, вторинним до саркоїдозу. У 85% випадків спостерігалося покращення внутрішньоочних запальних ознак, у той час як у 15% результати були стабільними. Поліпшення внутрішньоочного запалення включало зникнення васкуліту, ураження хоріоідеї, папіліту, макулярного набряку та помутніння склистого тіла у більшості пацієнтів, які мали відповідні ознаки на початковому рівні.95 Дослідження, проведене нашою групою, також показало, що всі 6 пацієнтів із саркоїдозним увеїтом із 31 пацієнта з різними діагнозами увеїту були визначені як пацієнти, які клінічно реагували на 10 тиждень, продемонструвавши або покращення гостроти зору, запалення ока, ангіографічні дані або здатність зменшувати ліки. Через 50 тижнів 3 пацієнти (50%) зберегли клінічний успіх, тоді як інші мали вторинну невдачу (1 через втрату ефективності, 1 через нездатність зменшити дозу кортикостероїдів і 1 через втрату спостереження).96
Етанерцепт, як правило, менш ефективний, ніж інфліксимаб та адалімумаб, для очних показань. У рандомізованому дослідженні не вдалося продемонструвати істотної різниці в контролі увеїту, пов’язаного з ювенільним ідіопатичним артритом, порівняно з плацебо.97 Baughman та інші рандомізували 18 пацієнтів з рефрактерним саркоїдозним увеїтом; 9 отримували етанерцепт і 9 отримували плацебо. Автори не виявили значного покращення очного запалення при терапії етанерцептом порівняно з плацебо.98
Повідомлялося, що голімумаб ефективний для лікування різних увеїтів у кількох серіях.99-103 Calvo-Río та інші повідомили про успішний контроль запалення у 2 пацієнтів з активним саркоїдозним увеїтом, які раніше не отримували інфліксимаб; однак періоди спостереження були обмежені 1 та 9 місяцями для кожного пацієнта.102 Про схожі висновки повідомили Кордеро-Кома та його колеги, які вивчали застосування голімумабу при увеїті; у 2 пацієнтів із саркоїдозним увеїтом, у яких раніше не було ефекту від інших інгібіторів TNF (1 з панувеїтом і макулярним набряком і 1 із проміжним увеїтом), було досягнуто повного контролю запалення після 6 місяців терапії голімумабом.103
Через обмежені довгострокові дані щодо безпеки та ефективності біологічна терапія зарезервована лише як вторинне або третинне лікування увеїту, асоційованого з саркоїдозом. Хоча рідко, є численні звіти та серії, які свідчать про те, що анти-TNF агенти (інфліксимаб104-109, адалімумаб108-110, етанерцепт107,108 і цертолізумаб111) можуть спричиняти саркоїдосхожі стани, включаючи увеїт.
• Лікування склеритів і зовнішніх захворювань очей
Нестероїдні протизапальні препарати (НПЗП) зазвичай призначають як терапію першої лінії при склериті. Пацієнтам, які не реагують на НПЗП, зазвичай корисні кортикостероїди. Одночасне застосування пероральних кортикостероїдів і НПЗЗ може спричинити значні побічні ефекти з боку шлунково-кишкового тракту. Пацієнтам, резистентним або непереносним до кортикостероїдів, можна застосовувати системні імуномодулятори. Наша група повідомила про успішне лікування непокірного склериту ритуксимабом у 75% пацієнтів; однак, частково через рідкість, жоден із цих пацієнтів не мав вторинного склериту стосовно саркоїдозу.112 В одному звіті про випадки талідомід був успішно застосований для лікування шкірного саркоїдозу та нодулярного склериту у пацієнта, якому терапія азатіоприном і кортикостероїдами не принесла результатів.113 Талідомід вважається заспокійливим, снодійним засобом, але також має протизапальну дію. Лікування перебуває під особливими правилами, оскільки може спричинити серйозні вроджені дефекти.
Окрім лікування системними кортикостероїдами, шкірні ураження повік можна лікувати ін’єкцією триамцинолону36 або пероральним прийманням хлорохіну.114 Ураження кон’юнктиви та ККС можуть реагувати на місцеві очні краплі циклоспорину.115,116
• Лікування ураження орбіти
Орбітальне запалення також зазвичай реагує на пероральні кортикостероїди та/або імуносупресори. У пацієнтів із доступними орбітальними ураженнями або з високою підозрою на можливу злоякісність необхідно виконати біопсію або видалення ураження. Поряд з ураженням орбіти також може спостерігатися косоокість та/або аномальне положення повік. Лікування спочатку повинно бути максимальним із застосуванням протизапальної терапії. При необхідності оперативного втручання спочатку слід провести операцію на орбіті, потім щодо косоокості та повік відповідно.
• Лікування очних ускладнень
Не слід ігнорувати лікування очних ускладнень, спричинених запаленням ока, та побічні ефекти терапії. Часто зустрічаються глаукома, катаракта, утворення епіретинальної мембрани й CME. Застосування кортикостероїдів слід звести до мінімуму, використовуючи альтернативні протизапальні засоби у пацієнтів зі значно підвищеним ВОТ. Операцію з видалення катаракти можна розглянути, коли внутрішньоочне запалення припиняється щонайменше на 3 місяці, щоб уникнути важкої післяопераційної запальної реакції. Системні та/або локальні кортикостероїди також можуть призначатися протягом післяопераційного періоду.
Найважливішим та ефективним способом лікування ХВМ є контроль внутрішньоочного запалення за допомогою протизапальної терапії.117 У пацієнтів, у яких CME зберігається без активного запалення, повідомлялося про інтравітреальні ін’єкції бевацизумабу118 або ранібізумабу119 як про можливу ефективну терапію для покращення зору та макулярної анатомії. Епіретинальну мембрану можна видалити хірургічним шляхом у тих, хто має візуально помітні складки. Проте лікування пов’язаного запалення та/або набряку має бути максимально ефективним до розгляду операції, щоб уникнути післяопераційного запалення та непотрібної операції.
Прогноз очного саркоїдозу
Візуальний прогноз при саркоїдозі ока може змінюватися залежно від тяжкості та хронічності запалення ока, затримки звернення до спеціаліста й очних ускладнень, спричинених увеїтом.9 Довгострокове прогностичне дослідження саркоїдозного увеїту показало, що більшість (54%) пацієнтів зберігали зір краще, ніж 20/40 в обох очах, і лише 4,6% втратили зір менше, ніж 20/120 в обох очах, через 10 років після початку увеїту в умовах офтальмологічного центру.120 Основними причинами необоротної втрати зору були глаукома та хронічна макулопатія, пов’язана із запаленням заднього сегмента. Тридцять п’ять (47%) із 75 пацієнтів мали екстраокулярне ураження на початку увеїту, а ще 17% – протягом наступних 10 років. П’ятдесят один відсоток пацієнтів потребував пероральних кортикостероїдів, а ще 11% потребували імуносупресивних препаратів для лікування увеїту. Приблизно одній п’ятій пацієнтів була проведена операція на очах, включаючи видалення катаракти (17%), трабекулектомію (4%), відновлення відшарування сітківки (1%) і пілінг епіретинальної мембрани (1%). Очний прогноз саркоїдозного увеїту, здавалося, не пов’язаний з наявністю екстраокулярного захворювання.120
У Фінляндії Karma та інші досліджували 281 пацієнта з підтвердженим біопсією саркоїдозом. З цих 281 пацієнта 21 пацієнт з увеїтом регулярно спостерігався. У восьми пацієнтів (38%) спостерігався монофазний перебіг увеїту, що потребував менше ніж 6 місяців лікування, тоді як у решти (13 пацієнтів; 62%) спостерігався рецидивний перебіг з численними рецидивами. В останній групі увеїт згодом вигорів після кількох років лікування у 9 із 13 пацієнтів.121 Це дослідження також показало, що на рентгенівському знімку грудної клітки пригрудкова аденопатія може зникнути, поки зберігаються очні ознаки. Це спостереження свідчить про те, що підгрупа пацієнтів з «ідіопатичним» увеїтом може мати саркоїдоз, що неможливо діагностувати за допомогою рутинного рентгена грудної клітки. 10-річне візуальне прогностичне дослідження 69 пацієнтів з периферичним мультифокальним хоріоретинітом показало, що наявність системного саркоїдозу не впливає на ризики розвитку CME, епіретинальної мембрани, катаракти, глаукоми або атрофії зорового нерва. CME був основною причиною зниження зору. Наявність епіретинальної мембрани не обов’язково впливає на кінцевий зір.18
Попри те, що саркоїдоз очей може виникати раптово та мати обмежений перебіг, дуже важливо поінформувати пацієнтів про потенційну хронізацію запалення очей. Для успішного лікування необхідні тривале спостереження та дотримання режиму лікування, щоб запобігти постійному пошкодженню зору як запаленням очей, так і побічними ефектами, пов’язаними з прийманням ліків.
Ключові моменти
- Очний саркоїдоз може вражати будь-яку частину ока та його придаткові тканини.
- Найбільш поширеними очними проявами є увеїт, сухість очей і кон’юнктивальні вузлики.
- Ураження очей є симптомом приблизно у 20-30% пацієнтів із саркоїдозом.
- Мультидисциплінарні підходи необхідні для досягнення найкращих результатів лікування як очних, так і системних проявів.
- При належному лікуванні візуальний прогноз загалом хороший.
Література
- Crick RP, Hoyle C, Smellie H. The Eyes in Sarcoidosis. Br J Ophthalmol. 1961;45(7):461–481. [PMC free article][PubMed] [Google Scholar]
- Rothova A. Ocular involvement in sarcoidosis. Br J Ophthalmol. 2000;84(1):110–116. [PMC free article][PubMed] [Google Scholar]
- Atmaca LS, Atmaca-Sonmez P, Idil A, Kumbasar OO, Celik G. Ocular involvement in sarcoidosis. Ocul Immunol Inflamm. 2009;17(2):91–94. [PubMed] [Google Scholar]
- Ohara K, Okubo A, Sasaki H, Kamata K. Intraocular manifestations of systemic sarcoidosis. Jpn J Ophthalmol. 1992;36(4):452–457. [PubMed] [Google Scholar]
- Heiligenhaus A, Wefelmeyer D, Wefelmeyer E, Rosel M, Schrenk M. The eye as a common site for the early clinical manifestation of sarcoidosis. Ophthalmic Res. 2011;46(1):9–12. [PubMed] [Google Scholar]
- Rothova A, Alberts C, Glasius E, Kijlstra A, Buitenhuis HJ, Breebaart AC. Risk factors for ocular sarcoidosis. Doc Ophthalmol. 1989;72(3-4):287–296. [PubMed] [Google Scholar]
- Hoover DL, Khan JA, Giangiacomo J. Pediatric ocular sarcoidosis. Surv Ophthalmol. 1986;30(4):215–228. [PubMed] [Google Scholar]
- Rose CD, Wouters CH, Meiorin S, Doyle TM, Davey MP, Rosenbaum JT, Martin TM. Pediatric granulomatous arthritis: an international registry. Arthritis Rheum. 2006;54(10):3337–3344. [PubMed] [Google Scholar]
- Dana MR, Merayo-Lloves J, Schaumberg DA, Foster CS. Prognosticators for visual outcome in sarcoid uveitis. Ophthalmology. 1996;103(11):1846–1853. [PubMed] [Google Scholar]
- Evans M, Sharma O, LaBree L, Smith RE, Rao NA. Differences in clinical findings between Caucasians and African Americans with biopsy-proven sarcoidosis. Ophthalmology. 2007;114(2):325–333. [PubMed] [Google Scholar]
- Birnbaum AD, Oh FS, Chakrabarti A, Tessler HH, Goldstein DA. Clinical features and diagnostic evaluation of biopsy-proven ocular sarcoidosis. Arch Ophthalmol. 2011;129(4):409–413. [PubMed] [Google Scholar]
- Kump LI, Cervantes-Castaneda RA, Androudi SN, Foster CS. Analysis of pediatric uveitis cases at a tertiary referral center. Ophthalmology. 2005;112(7):1287–1292. [PubMed] [Google Scholar]
- Smith JA, Mackensen F, Sen HN, Leigh JF, Watkins AS, Pyatetsky D, Tessler HH, Nussenblatt RB, Rosenbaum JT, Reed GF, Vitale S, Smith JR, Goldstein DA. Epidemiology and course of disease in childhood uveitis. Ophthalmology. 2009;116(8):1544–1551. 1551 e1541. [PMC free article][PubMed] [Google Scholar]
- Rodriguez A, Calonge M, Pedroza-Seres M, Akova YA, Messmer EM, D'Amico DJ, Foster CS. Referral patterns of uveitis in a tertiary eye care center. Arch Ophthalmol. 1996;114(5):593–599. [PubMed] [Google Scholar]
- Merrill PT, Kim J, Cox TA, Betor CC, McCallum RM, Jaffe GJ. Uveitis in the southeastern United States. Curr Eye Res. 1997;16(9):865–874. [PubMed] [Google Scholar]
- Sungur G, Hazirolan D, Bilgin G. Pattern of ocular findings in patients with biopsy-proven sarcoidosis in Turkey. Ocul Immunol Inflamm. 2013;21(6):455–461. [PubMed] [Google Scholar]
- Abad S, Meyssonier V, Allali J, Gouya H, Giraudet AL, Monnet D, Parc C, Tenenbaum F, Alberini JL, Grabar S, Pesce F, Rollot F, Sicard D, Dhote R, Blanche P, Brezin AP. Association of peripheral multifocal choroiditis with sarcoidosis: a study of thirty-seven patients. Arthritis Rheum. 2004;51(6):974–982. [PubMed] [Google Scholar]
- Ossewaarde-van Norel J, Ten Dam-van Loon N, de Boer JH, Rothova A. Long-term visual prognosis of peripheral multifocal chorioretinitis. Am J Ophthalmol. 2015;159(4):690–697. [PubMed] [Google Scholar]
- Rossman MD, Thompson B, Frederick M, Maliarik M, Iannuzzi MC, Rybicki BA, Pandey JP, Newman LS, Magira E, Beznik-Cizman B, Monos D, Group A. HLA-DRB1*1101: a significant risk factor for sarcoidosis in blacks and whites. Am J Hum Genet. 2003;73(4):720–735. [PMC free article][PubMed] [Google Scholar]
- Jabs DA, Nussenblatt RB, Rosenbaum JT, Standardization of Uveitis Nomenclature Working G Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol. 2005;140(3):509–516. [PMC free article][PubMed] [Google Scholar]
- Zaidi AA, Ying GS, Daniel E, Gangaputra S, Rosenbaum JT, Suhler EB, Thorne JE, Foster CS, Jabs DA, Levy-Clarke GA, Nussenblatt RB, Kempen JH, Systemic Immunosuppressive Therapy for Eye Diseases Cohort S Hypopyon in patients with uveitis. Ophthalmology. 2010;117(2):366–372. [PMC free article][PubMed] [Google Scholar]
- Spalton DJ, Sanders MD. Fundus changes in histologically confirmed sarcoidosis. Br J Ophthalmol. 1981;65(5):348–358. [PMC free article][PubMed] [Google Scholar]
- Letocha CE, Shields JA, Goldberg RE. Retinal changes in sarcoidosis. Can J Ophthalmol. 1975;10(2):184–192. [PubMed] [Google Scholar]
- Gould H, Kaufman HE. Sarcoid of the fundus. Arch Ophthalmol. 1961;65:453–456. [PubMed] [Google Scholar]
- Hoogstede HA, Copper AC. A case of macular subretinal neovascularisation in chronic uveitis probably caused by sarcoidosis. Br J Ophthalmol. 1982;66(8):530–535. [PMC free article][PubMed] [Google Scholar]
- Khurana RN, Parikh JG, Rao NA. Sarcoid choroiditis simulating birdshot chorioretinopathy. Retin Cases Brief Rep. 2008;2(4):301–303. [PubMed] [Google Scholar]
- Delaney P. Neurologic manifestations in sarcoidosis: review of the literature, with a report of 23 cases. Ann Intern Med. 1977;87(3):336–345. [PubMed] [Google Scholar]
- Phillips YL, Eggenberger ER. Neuro-ophthalmic sarcoidosis. Curr Opin Ophthalmol. 2010;21(6):423–429. [PubMed] [Google Scholar]
- Gass JD, Olson CL. Sarcoidosis with optic nerve and retinal involvement. Arch Ophthalmol. 1976;94(6):945–950. [PubMed] [Google Scholar]
- Zajicek JP, Scolding NJ, Foster O, Rovaris M, Evanson J, Moseley IF, Scadding JW, Thompson EJ, Chamoun V, Miller DH, McDonald WI, Mitchell D. Central nervous system sarcoidosis--diagnosis and management. QJM. 1999;92(2):103–117. [PubMed] [Google Scholar]
- Oie K, Tanigawa K, Suganuma Y, Matsushima Y, Inaba Y. [A case of CNS sarcoidosis -case report of hydrocephalus due to mechanical obstruction secondary to sarcoid granulomata at the outlet of the fourth ventricle (author's transl)] No Shinkei Geka. 1981;9(1):75–78. [PubMed] [Google Scholar]
- Zhang J, Waisbren E, Hashemi N, Lee AG. Visual hallucinations (Charles Bonnet syndrome) associated with neurosarcoidosis. Middle East Afr J Ophthalmol. 2013;20(4):369–371. [PMC free article][PubMed] [Google Scholar]
- Yaosaka M, Abe R, Ujiie H, Abe Y, Shimizu H. Unilateral periorbital oedema due to sarcoid infiltration of the eyelid: an unusual presentation of sarcoidosis with facial nerve palsy and parotid gland enlargement. Br J Dermatol. 2007;157(1):200–202. [PubMed] [Google Scholar]
- Pessoa de Souza Filho J, Martins MC, Sant'Anna AE, Coutinho AB, Burnier MN, Jr., Rigueiro MP. Eyelid swelling as the only manifestation of ocular sarcoidosis. Ocul Immunol Inflamm. 2005;13(5):399–402. [PubMed] [Google Scholar]
- Hall JG, Cohen KL. Sarcoidosis of the eyelid skin. Am J Ophthalmol. 1995;119(1):100–101. [PubMed] [Google Scholar]
- Kim YJ, Kim YD. A case of scar sarcoidosis of the eyelid. Korean J Ophthalmol. 2006;20(4):238–240. [PMC free article][PubMed] [Google Scholar]
- Collins ME, Petronic-Rosic V, Sweiss NJ, Marcet MM. Full-thickness eyelid lesions in sarcoidosis. Case Rep Ophthalmol Med. 2013;2013:579121. [PMC free article][PubMed] [Google Scholar]
- Moin M, Kersten RC, Bernardini F, Kulwin DR. Destructive eyelid lesions in sarcoidosis. Ophthal Plast Reconstr Surg. 2001;17(2):123–125. [PubMed] [Google Scholar]
- Behbehani R, Nipper KS, Eagle RC, Jr., Bilyk JR. Systemic sarcoidosis manifested as unilateral eyelid retraction. Arch Ophthalmol. 2006;124(4):599–600. [PubMed] [Google Scholar]
- Hegab SM, al-Mutawa SA, Sheriff SM. Sarcoidosis presenting as multilobular limbal corneal nodules. J Pediatr Ophthalmol Strabismus. 1998;35(6):323–326. [PubMed] [Google Scholar]
- Dithmar S, Waring GO, 3rd, Goldblum TA, Grossniklaus HE. Conjunctival deposits as an initial manifestation of sarcoidosis. Am J Ophthalmol. 1999;128(3):361–362. [PubMed] [Google Scholar]
- Papadaki TG, Kafkala C, Zacharopoulos IP, Seyedahmadi BJ, Dryja T, Foster CS. Conjunctival non-caseating granulomas in a human immunodeficiency virus (HIV) positive patient attributed to sarcoidosis. Ocul Immunol Inflamm. 2006;14(5):309–311. [PubMed] [Google Scholar]
- Manrique Lipa RK, de los Bueis AB, De los Rios JJ, Manrique Lipa RD. Sarcoidosis presenting as acute bulbar follicular conjunctivitis. Clin Exp Optom. 2010;93(5):363–365. [PubMed] [Google Scholar]
- Geggel HS, Mensher JH. Cicatricial conjunctivitis in sarcoidosis: recognition and treatment. Ann Ophthalmol. 1989;21(3):92–94. [PubMed] [Google Scholar]
- Flach A. Symblepharon in sarcoidosis. Am J Ophthalmol. 1978;85(2):210–214. [PubMed] [Google Scholar]
- Schilgen G, Sundmacher R, Pomjanski N, Bocking A, Reinecke P, Gabbert HE. [Bilateral large conjunctival tumours as primary manifestation of sarcoidosis--successful treatment with steroid-depot-injections] Klin Monbl Augenheilkd. 2006;223(4):326–329. [PubMed] [Google Scholar]
- Dursun D, Akova YA, Bilezikci B. Scleritis associated with sarcoidosis. Ocul Immunol Inflamm. 2004;12(2):143–148. [PubMed] [Google Scholar]
- Heiligenhaus A, Michel D, Koch JM. Nodular scleritis in a patient with sarcoidosis. Br J Ophthalmol. 2003;87(4):507–508. [PMC free article][PubMed] [Google Scholar]
- Babu K, Kini R, Mehta R. Scleral nodule and bilateral disc edema as a presenting manifestation of systemic sarcoidosis. Ocul Immunol Inflamm. 2010;18(3):158–161. [PubMed] [Google Scholar]
- Dodds EM, Lowder CY, Barnhorst DA, Lavertu P, Caravella LP, White DE. Posterior scleritis with annular ciliochoroidal detachment. Am J Ophthalmol. 1995;120(5):677–679. [PubMed] [Google Scholar]
- Riono WP, Hidayat AA, Rao NA. Scleritis: a clinicopathologic study of 55 cases. Ophthalmology. 1999;106(7):1328–1333. [PubMed] [Google Scholar]
- Lennarson P, Barney NP. Interstitial keratitis as presenting ophthalmic sign of sarcoidosis in a child. J Pediatr Ophthalmol Strabismus. 1995;32(3):194–196. [PubMed] [Google Scholar]
- Siracuse-Lee D, Saffra N. Peripheral ulcerative keratitis in sarcoidosis: a case report. Cornea. 2006;25(5):618–620. [PubMed] [Google Scholar]
- Mavrikakis I, Rootman J. Diverse clinical presentations of orbital sarcoid. Am J Ophthalmol. 2007;144(5):769–775. [PubMed] [Google Scholar]
- Prabhakaran VC, Saeed P, Esmaeli B, Sullivan TJ, McNab A, Davis G, Valenzuela A, Leibovitch I, Kesler A, Sivak-Callcott J, Hoyama E, Selva D. Orbital and adnexal sarcoidosis. Arch Ophthalmol. 2007;125(12):1657–1662. [PubMed] [Google Scholar]
- Demirci H, Christianson MD. Orbital and adnexal involvement in sarcoidosis: analysis of clinical features and systemic disease in 30 cases. Am J Ophthalmol. 2011;151(6):1074–1080. e1071. [PubMed] [Google Scholar]
- Jones BR, Stevenson CJ. Keratoconjunctivitis sicca due to sarcoidosis. Br J Ophthalmol. 1957;41(3):153–160. [PMC free article][PubMed] [Google Scholar]
- Chapman KL, Bartley GB, Garrity JA, Gonnering RS. Lacrimal bypass surgery in patients with sarcoidosis. Am J Ophthalmol. 1999;127(4):443–446. [PubMed] [Google Scholar]
- Kay DJ, Saffra N, Har-El G. Isolated sarcoidosis of the lacrimal sac without systemic manifestations. Am J Otolaryngol. 2002;23(1):53–55. [PubMed] [Google Scholar]
- Kim DS, Korgavkar K, Zahid S, De Lott L, Prabhakar A, Foerster BR, Besirli CG. Vision Loss After Central Retinal Artery Occlusion Secondary to Orbital Sarcoid Mass. Ophthal Plast Reconstr Surg. 2014 [PubMed] [Google Scholar]
- Jabs DA, Johns CJ. Ocular involvement in chronic sarcoidosis. Am J Ophthalmol. 1986;102(3):297–301. [PubMed] [Google Scholar]
- Shimizu A, Maruyama K, Yokoyama Y, Tsuda S, Ryu M, Nakazawa T. Characteristics of uveitic glaucoma and evaluation of its surgical treatment. Clin Ophthalmol. 2014;8:2383–2389. [PMC free article][PubMed] [Google Scholar]
- Herbort CP, Rao NA, Mochizuki M, members of Scientific Committee of First International Workshop on Ocular S International criteria for the diagnosis of ocular sarcoidosis: results of the first International Workshop On Ocular Sarcoidosis (IWOS) Ocul Immunol Inflamm. 2009;17(3):160–169. [PubMed] [Google Scholar]
- Nichols CW, Eagle RC, Jr., Yanoff M, Menocal NG. Conjunctival biopsy as an aid in the evaluation of the patient with suspected sarcoidosis. Ophthalmology. 1980;87(4):287–291. [PubMed] [Google Scholar]
- Karcioglu ZA, Brear R. Conjunctival biopsy in sarcoidosis. Am J Ophthalmol. 1985;99(1):68–73. [PubMed] [Google Scholar]
- Bornstein JS, Frank MI, Radner DB. Conjunctival biopsy in the diagnosis of sarcoidosis. N Engl J Med. 1962;267:60–64. [PubMed] [Google Scholar]
- Wertheim MS, Mathers WD, Lim L, Watkins AS, Mackensen F, O'Malley JP, Rosenbaum JT. Non-invasive detection of multinucleated giant cells in the conjunctiva of patients with sarcoidosis by in-vivo confocal microscopy. Ocul Immunol Inflamm. 2006;14(4):203–206. [PubMed] [Google Scholar]
- Rose-Nussbaumer J, Li Y, Lin P, Suhler E, Asquith M, Rosenbaum JT, Huang D. Aqueous cell differentiation in anterior uveitis using fourier-domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2015;56(3):1430–1436. [PMC free article][PubMed] [Google Scholar]
- Gungor SG, Akkoyun I, Reyhan NH, Yesilirmak N, Yilmaz G. Choroidal thickness in ocular sarcoidosis during quiescent phase using enhanced depth imaging optical coherence tomography. Ocul Immunol Inflamm. 2014;22(4):287–293. [PubMed] [Google Scholar]
- Ma J, Chen T, Mandelin J, Ceponis A, Miller NE, Hukkanen M, Ma GF, Konttinen YT. Regulation of macrophage activation. Cell Mol Life Sci. 2003;60(11):2334–2346. [PubMed] [Google Scholar]
- Rosenbaum JT, Pasadhika S, Crouser ED, Choi D, Harrington CA, Lewis JA, Austin CR, Diebel TN, Vance EE, Braziel RM, Smith JR, Planck SR. Hypothesis: sarcoidosis is a STAT1-mediated disease. Clin Immunol. 2009;132(2):174–183. [PMC free article][PubMed] [Google Scholar]
- Rosenbaum JT, Hessellund A, Phan I, Planck SR, Wilson DJ. The expression of STAT-1 and phosphorylated STAT-1 in conjunctival granulomas. Ocul Immunol Inflamm. 2010;18(4):261–264. [PMC free article][PubMed] [Google Scholar]
- Rosenbaum JT, Choi D, Wilson DJ, Grossniklaus HE, Harrington CA, Sibley CH, Dailey RA, Ng JD, Steele EA, Czyz CN, Foster JA, Tse D, Alabiad C, Dubovy S, Parekh P, Harris GJ, Kazim M, Patel P, White V, Dolman P, Korn BS, Kikkawa D, Edward DP, Alkatan H, Al-Hussain H, Yeatts RP, Selva D, Stauffer P, Planck SR. Parallel Gene Expression Changes in Sarcoidosis Involving the Lacrimal Gland, Orbital Tissue, or Blood. JAMA Ophthalmol. 2015 [PMC free article][PubMed] [Google Scholar]
- Sheppard JD, Toyos MM, Kempen JH, Kaur P, Foster CS. Difluprednate 0.05% versus prednisolone acetate 1% for endogenous anterior uveitis: a phase III, multicenter, randomized study. Invest Ophthalmol Vis Sci. 2014;55(5):2993–3002. [PMC free article][PubMed] [Google Scholar]
- Khurana RN, Porco TC. Efficacy and Safety of Dexamethasone Intravitreal Implant for Persistent Uveitic Cystoid Macular Edema. Retina. 2015 [PubMed] [Google Scholar]
- Ozkok A, Saleh OA, Sigford DK, Heroman JW, Schaal S. THE OMAR STUDY: Comparison of Ozurdex and Triamcinolone Acetonide for Refractory Cystoid Macular Edema in Retinal Vein Occlusion. Retina. 2015 [PubMed] [Google Scholar]
- Jaffe GJ, Martin D, Callanan D, Pearson PA, Levy B, Comstock T, Fluocinolone Acetonide Uveitis Study G Fluocinolone acetonide implant (Retisert) for noninfectious posterior uveitis: thirty-four-week results of a multicenter randomized clinical study. Ophthalmology. 2006;113(6):1020–1027. [PubMed] [Google Scholar]
- Goldstein DA, Godfrey DG, Hall A, Callanan DG, Jaffe GJ, Pearson PA, Usner DW, Comstock TL. Intraocular pressure in patients with uveitis treated with fluocinolone acetonide implants. Arch Ophthalmol. 2007;125(11):1478–1485. [PubMed] [Google Scholar]
- Multicenter Uveitis Steroid Treatment Trial Research G. Sugar EA, Holbrook JT, Kempen JH, Burke AE, Drye LT, Thorne JE, Louis TA, Jabs DA, Altaweel MM, Frick KD. Cost-effectiveness of fluocinolone acetonide implant versus systemic therapy for noninfectious intermediate, posterior, and panuveitis. Ophthalmology. 2014;121(10):1855–1862. [PMC free article][PubMed] [Google Scholar]
- Dev S, McCallum RM, Jaffe GJ. Methotrexate treatment for sarcoid-associated panuveitis. Ophthalmology. 1999;106(1):111–118. [PubMed] [Google Scholar]
- Bhat P, Cervantes-Castaneda RA, Doctor PP, Anzaar F, Foster CS. Mycophenolate mofetil therapy for sarcoidosis-associated uveitis. Ocul Immunol Inflamm. 2009;17(3):185–190. [PubMed] [Google Scholar]
- Walton RC, Nussenblatt RB, Whitcup SM. Cyclosporine therapy for severe sight-threatening uveitis in children and adolescents. Ophthalmology. 1998;105(11):2028–2034. [PubMed] [Google Scholar]
- Murphy CC, Greiner K, Plskova J, Duncan L, Frost NA, Forrester JV, Dick AD. Cyclosporine vs tacrolimus therapy for posterior and intermediate uveitis. Arch Ophthalmol. 2005;123(5):634–641. [PubMed] [Google Scholar]
- Jabs DA, Rosenbaum JT, Foster CS, Holland GN, Jaffe GJ, Louie JS, Nussenblatt RB, Stiehm ER, Tessler H, Van Gelder RN, Whitcup SM, Yocum D. Guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders: recommendations of an expert panel. Am J Ophthalmol. 2000;130(4):492–513. [PubMed] [Google Scholar]
- Gangaputra S, Newcomb CW, Liesegang TL, Kacmaz RO, Jabs DA, Levy-Clarke GA, Nussenblatt RB, Rosenbaum JT, Suhler EB, Thorne JE, Foster CS, Kempen JH, Systemic Immunosuppressive Therapy for Eye Diseases Cohort S Methotrexate for ocular inflammatory diseases. Ophthalmology. 2009;116(11):2188–2198. e2181. [PMC free article][PubMed] [Google Scholar]
- Daniel E, Thorne JE, Newcomb CW, Pujari SS, Kacmaz RO, Levy-Clarke GA, Nussenblatt RB, Rosenbaum JT, Suhler EB, Foster CS, Jabs DA, Kempen JH. Mycophenolate mofetil for ocular inflammation. Am J Ophthalmol. 2010;149(3):423–432. e421-422. [PMC free article][PubMed] [Google Scholar]
- Pasadhika S, Kempen JH, Newcomb CW, Liesegang TL, Pujari SS, Rosenbaum JT, Thorne JE, Foster CS, Jabs DA, Levy-Clarke GA, Nussenblatt RB, Suhler EB. Azathioprine for ocular inflammatory diseases. Am J Ophthalmol. 2009;148(4):500–509. e502. [PMC free article][PubMed] [Google Scholar]
- Kacmaz RO, Kempen JH, Newcomb C, Daniel E, Gangaputra S, Nussenblatt RB, Rosenbaum JT, Suhler EB, Thorne JE, Jabs DA, Levy-Clarke GA, Foster CS. Cyclosporine for ocular inflammatory diseases. Ophthalmology. 2010;117(3):576–584. [PMC free article][PubMed] [Google Scholar]
- Jaffe GJ, Thorne JE, Scales D, Franco P, Tari SR, Camez A, Song AP, Kron M, Barisani-Asenbauer T, Dick AD. Adalimumab in patients with active, non-infectious uveitis requiring high-dose corticosteroids: the VISUAL-1 trial. ARVO 2015 Annual Meeting Abstracts by Scientific Section/Group - Immunology/Microbiology. 2015:73–74. [Google Scholar]
- Suhler EB, Smith JR, Wertheim MS, Lauer AK, Kurz DE, Pickard TD, Rosenbaum JT. A prospective trial of infliximab therapy for refractory uveitis: preliminary safety and efficacy outcomes. Arch Ophthalmol. 2005;123(7):903–912. [PubMed] [Google Scholar]
- Suhler EB, Smith JR, Giles TR, Lauer AK, Wertheim MS, Kurz DE, Kurz PA, Lim L, Mackensen F, Pickard TD, Rosenbaum JT. Infliximab therapy for refractory uveitis: 2-year results of a prospective trial. Arch Ophthalmol. 2009;127(6):819–822. [PubMed] [Google Scholar]
- Pritchard C, Nadarajah K. Tumour necrosis factor alpha inhibitor treatment for sarcoidosis refractory to conventional treatments: a report of five patients. Ann Rheum Dis. 2004;63(3):318–320. [PMC free article][PubMed] [Google Scholar]
- Doty JD, Mazur JE, Judson MA. Treatment of sarcoidosis with infliximab. Chest. 2005;127(3):1064–1071. [PubMed] [Google Scholar]
- Benitez-del-Castillo JM, Martinez-de-la-Casa JM, Pato-Cour E, Mendez-Fernandez R, Lopez-Abad C, Matilla M, Garcia-Sanchez J. Long-term treatment of refractory posterior uveitis with anti-TNFalpha (infliximab) Eye (Lond) 2005;19(8):841–845. [PubMed] [Google Scholar]
- Erckens RJ, Mostard RL, Wijnen PA, Schouten JS, Drent M. Adalimumab successful in sarcoidosis patients with refractory chronic non-infectious uveitis. Graefes Arch Clin Exp Ophthalmol. 2012;250(5):713–720. [PMC free article][PubMed] [Google Scholar]
- Suhler EB, Lowder CY, Goldstein DA, Giles T, Lauer AK, Kurz PA, Pasadhika S, Lee ST, de Saint Sardos A, Butler NJ, Tessler HH, Smith JR, Rosenbaum JT. Adalimumab therapy for refractory uveitis: results of a multicentre, open-label, prospective trial. Br J Ophthalmol. 2013;97(4):481–486. [PubMed] [Google Scholar]
- Smith JA, Thompson DJ, Whitcup SM, Suhler E, Clarke G, Smith S, Robinson M, Kim J, Barron KS. A randomized, placebo-controlled, double-masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum. 2005;53(1):18–23. [PubMed] [Google Scholar]
- Baughman RP, Lower EE, Bradley DA, Raymond LA, Kaufman A. Etanercept for refractory ocular sarcoidosis: results of a double-blind randomized trial. Chest. 2005;128(2):1062–1047. [PubMed] [Google Scholar]
- William M, Faez S, Papaliodis GN, Lobo AM. Golimumab for the treatment of refractory juvenile idiopathic arthritis-associated uveitis. J Ophthalmic Inflamm Infect. 2012;2(4):231–233. [PMC free article][PubMed] [Google Scholar]
- Cordero-Coma M, Salom D, Diaz-Llopis M, Lopez-Prats MJ, Calleja S. Golimumab for uveitis. Ophthalmology. 2011;118(9):1892. e1893-1894. [PubMed] [Google Scholar]
- Miserocchi E, Modorati G, Pontikaki I, Meroni P, Gerloni V. Golimumab treatment for complicated uveitis. Clin Exp Rheumatol. 2013;31(2):320–321. [PubMed] [Google Scholar]
- Calvo-Rio V, de la Hera D, Blanco R, Beltran-Catalan E, Loricera J, Canal J, Ventosa J, Cifrian JM, Ortiz-Sanjuan F, Rueda-Gotor J, Gonzalez-Vela MC, Gonzalez-Lopez M, Gonzalez-Gay MA. Golimumab in uveitis previously treated with other anti-TNF-alpha drugs: a retrospective study of three cases from a single centre and literature review. Clin Exp Rheumatol. 2014;32(6):864–868. [PubMed] [Google Scholar]
- Cordero-Coma M, Calvo-Rio V, Adan A, Blanco R, Alvarez-Castro C, Mesquida M, Calleja S, Gonzalez-Gay MA, Ruiz de Morales JG. Golimumab as rescue therapy for refractory immune-mediated uveitis: a three-center experience. Mediators Inflamm. 2014;2014:717598. [PMC free article][PubMed] [Google Scholar]
- Izzi S, Francesconi F, Visca P, Altieri A, De Mutiis C, Trevisan G, Bonifati C. Pulmonary sarcoidosis in a patient with psoriatic arthritis during infliximab therapy. Dermatol Online J. 2010;16(5):16. [PubMed] [Google Scholar]
- Olivier A, Gilson B, Lafontaine S, Pautot JX, Bindi P. [Pulmonary and renal involvement in a TNFalpha antagonist drug-induced sarcoidosis] Rev Med Interne. 2012;33(5):e25, 27. [PubMed] [Google Scholar]
- Takahashi H, Kaneta K, Honma M, Ishida-Yamamoto A, Ashida T, Kohgo Y, Ohsaki Y, Iizuka H. Sarcoidosis during infliximab therapy for Crohn's disease. J Dermatol. 2010;37(5):471–474. [PubMed] [Google Scholar]
- Clementine RR, Lyman J, Zakem J, Mallepalli J, Lindsey S, Quinet R. Tumor necrosis factor-alpha antagonist-induced sarcoidosis. J Clin Rheumatol. 2010;16(6):274–279. [PubMed] [Google Scholar]
- Daien CI, Monnier A, Claudepierre P, Constantin A, Eschard JP, Houvenagel E, Samimi M, Pavy S, Pertuiset E, Toussirot E, Combe B, Morel J, Club Rhumatismes et I Sarcoid-like granulomatosis in patients treated with tumor necrosis factor blockers: 10 cases. Rheumatology (Oxford) 2009;48(8):883–886. [PubMed] [Google Scholar]
- Dhaille F, Viseux V, Caudron A, Dadban A, Tribout C, Boumier P, Clabaut A, Lok C. Cutaneous sarcoidosis occurring during anti-TNF-alpha treatment: report of two cases. Dermatology. 2010;220(3):234–237. [PubMed] [Google Scholar]
- Metyas SK, Tadros RM, Arkfeld DG. Adalimumab-induced noncaseating granuloma in the bone marrow of a patient being treated for rheumatoid arthritis. Rheumatol Int. 2009;29(4):437–439. [PubMed] [Google Scholar]
- Moisseiev E, Shulman S. Certolizumab-induced uveitis: a case report and review of the literature. Case Rep Ophthalmol. 2014;5(1):54–59. [PMC free article][PubMed] [Google Scholar]
- Suhler EB, Lim LL, Beardsley RM, Giles TR, Pasadhika S, Lee ST, de Saint Sardos A, Butler NJ, Smith JR, Rosenbaum JT. Rituximab therapy for refractory scleritis: results of a phase I/II dose-ranging, randomized, clinical trial. Ophthalmology. 2014;121(10):1885–1891. [PubMed] [Google Scholar]
- Huddleston SM, Houser KH, Walton RC. Thalidomide for recalcitrant nodular scleritis in sarcoidosis. JAMA Ophthalmol. 2014;132(11):1377–1379. [PubMed] [Google Scholar]
- Brownstein S, Liszauer AD, Carey WD, Nicolle DA. Sarcoidosis of the eyelid skin. Can J Ophthalmol. 1990;25(5):256–259. [PubMed] [Google Scholar]
- Oh JY, Wee WR. Cyclosporine for conjunctival sarcoidosis. Ophthalmology. 2008;115(1):222. [PubMed] [Google Scholar]
- Akpek EK, Ilhan-Sarac O, Green WR. Topical cyclosporin in the treatment of chronic sarcoidosis of the conjunctiva. Arch Ophthalmol. 2003;121(9):1333–1335. [PubMed] [Google Scholar]
- Pasadhika S, Smith JR. Treatment of uveitic macular edema: an overview and update. Ophthalmology International. 2008:97–103. Spring. [Google Scholar]
- Cordero Coma M, Sobrin L, Onal S, Christen W, Foster CS. Intravitreal bevacizumab for treatment of uveitic macular edema. Ophthalmology. 2007;114(8):1574–1579. e1571. [PubMed] [Google Scholar]
- Acharya NR, Hong KC, Lee SM. Ranibizumab for refractory uveitis-related macular edema. Am J Ophthalmol. 2009;148(2):303–309. e302. [PubMed] [Google Scholar]
- Edelsten C, Pearson A, Joynes E, Stanford MR, Graham EM. The ocular and systemic prognosis of patients presenting with sarcoid uveitis. Eye (Lond) 1999;13:748–753. Pt 6. [PubMed] [Google Scholar]
- Karma A, Huhti E, Poukkula A. Course and outcome of ocular sarcoidosis. Am J Ophthalmol. 1988;106(4):467–472. [PubMed] [Google Scholar]







Коментарі
Завантаження...