Лікування неоваскуляризації рогівки за допомогою бевацизумабу
Інші публікації цього автора
Krizova Deli
Інші публікації цього автора
Vokrojova Magdalena
Інші публікації цього автора
Liehneova Katerina
Інші публікації цього автора
Studeny Pavel
Інші публікації цього автора
Лікування неоваскуляризації рогівки за допомогою бевацизумабу
Hindawi Publishing Corporation
Journal of Ophthalmology
Volume 2014, Article ID 178132, 7 pages
http://dx.doi.org/10.1155/2014/178132
Клінічне дослідження
Ophthalmology Department, 3rd Medical Faculty of Charles University and University Hospital Kralovske Vinohrady, Srobarova 50, 10034 Prague, Czech Republic
Correspondence should be addressed to Deli Krizova; [email protected]
Received 14 December 2013; Revised 18 February 2014; Accepted 19 February 2014; Published 23 March 2014
Academic Editor: Francisco Javier Romero
Copyright © 2014 Deli Krizova et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Анотація
Мета. Оцінити антиангіогенний ефект місцевого застосування бевацизумабу (антитіла до VEGF) у пацієнтів з неоваскуляризацією рогівки.
Методи. Пацієнти були розділені на дві групи. Усі пацієнти страждали від тієї чи іншої форми неоваскуляризації рогівки (НВ). Пацієнти групи А отримували 0,2-0,5 мл розчину бевацизумабу субкон’юнктивально (концентрація 25 мг/мл) одноразово. Група A включала 28 очей із 27. Пацієнти групи B застосовували очні краплі бевацизумаб двічі на день (концентрація 2,5 мг/мл) протягом двох тижнів. Група Б включала 38 очей від 35 пацієнтів. Оцінювали кількість сегментів рогівки, уражених НВ, СГЗВ, а також частоту ускладнень і суб’єктивних скарг, пов’язаних з лікуванням. Мінімальний період спостереження становив шість місяців.
Результати. Через 6 місяців спостереження у групі А відсоткове зменшення уражених периферичних сегментів становило 21,6 %, а центральних сегментів – 9,6 %; у групі Б відсоткове зменшення центральних сегментів становило 22,7%, а центральних сегментів – 38,04%. В обох групах ми помітили статистично значуще зниження ступеня НВ.
Висновок. Застосування бевацизумабу є ефективним і безпечним методом лікування неоваскуляризації рогівки як у формі субкон’юнктивального, так і місцевого застосування.
Ознайомитися з повним текстом статті можна нижче.
Клініка «АЙЛАЗ» займається лікуванням складних випадків патології рогівки.
1. Введення
Прозорість рогівки визначається багатьма чинниками, включаючи аваскулярність. З 1872 року, коли Арнольд продемонстрував, що процес ангіогенезу використовує смужки внутрішньоклітинного цементу для формування неоваскуляризації (НВ) у рогівці [1], були опубліковані результати нових досліджень, які вивчають процес утворення нових судин у рогівці. [2, 3]. Останні дослідження були зосереджені на розумінні механізмів, що утримують безсудинну рогівку в гомеостатичних умовах і забезпечують безсудинний процес загоєння. Ці дослідження сходяться на тому, що ангіогенний стан рогівки включає кілька активних каскадів і тому не є пасивним процесом [4-7].
НВ рогівки – це патологічне вростання судин до рогівки з лімбального судинного сплетення. Цей процес є результатом хронічного зменшення оксигенації рогівки. Фізіологічно кисень поглинається з повітря. Іншими причинами утворення патологічних судин на рогівці є інфекції рогівки, травми та імунологічні процеси. НВ рогівки може протікати безсимптомно та частіше призводить до серйозних розладів зору, а в деяких випадках до практичної сліпоти через суттєве помутніння рогівки. Загальнодоступна терапія обмежується усуненням основної причини утворення нової судини в рогівці, місцевим застосуванням кортикостероїдів, лазерною фотокоагуляцією судин і трансплантацією рогівки в екстремальних випадках [3].
In vitro виділено багато стимуляторів та інгібіторів, що регулюють ангіогенез. Показано, що чинники з сімейства васкулярного ендотеліального чинника росту (VEGF) є основними медіаторами цього процесу [8]. VEGF спочатку був визначений як стимулятор проникності судин (так званий VPF (чинник проникності судин)), але згодом було показано, що він є мітогенним і ангіогенним чинником, особливо для ендотеліальних клітин. Після виділення VEGF додаткові виділені чинники з сімейства VEGF були названі VEGF-B, VEGF-C і VEGF-D. Оригінальна форма зараз називається VEGF-A. Чинники VEGF є частиною сімейства супергенів VEGF/PDGF (тромбоцитарний чинник росту) [6, 9, 10]. VEGF-A зв’язується з рецепторами VEGFR-1 і VEGFR-2, та його експресія регулюється [11]. Збільшення продукції VEGF-A спостерігалося у випадках гіпоксії та під час запалення. Надмірна продукція VEGF-A спостерігалася при проліферації пухлинних клітин, подібно до утворення неоваскуляризації рогівки. VEGF-A підтримує кілька етапів ангіогенезу, включаючи протеолітичну активність, проліферацію ендотеліальних клітин судин, міграцію та формування просвіту капілярів [10, 12]. Важливість VEGF-A в ангіогенезі рогівки була продемонстрована експериментально на тваринних моделях шляхом інгібування НВ після стромального нанесення антитіл проти VEGF-A [13].
Бевацизумаб (Avastin, Roche) – це антитіло, що діє проти всіх ізоформ VEGF. Ця молекула пригнічує взаємодію між VEGF і його рецепторами, блокуючи будь-яку активність VEGF [14]. Наразі бевацизумаб схвалений для лікування колоректальної карциноми, карциноми молочної залози, недрібноклітинної карциноми легені та карциноми нирки. Він широко використовується «не за призначенням» для лікування хоріоїдальної неоваскуляризації внаслідок вікової дегенерації жовтої плями [15].
2. Матеріали та методи
Дослідження випадків проводили в офтальмологічному відділенні 3-го медичного факультету університетської лікарні Краловські Виногради з грудня 2007 р. по червень 2011 р. Застосування бевацизумабу «не за призначенням» для лікування НВ рогівки в обох формах застосування було схвалено місцевим комітетом з етики (Комітет університетської лікарні Краловські Виногради). Дотримувалися принципів Гельсінської декларації та всі пацієнти дали свою інформовану згоду перед лікуванням.
Дослідження було розроблено як проспективна, нерандомізована та непорівнянна серія випадків. Групи пацієнтів налічували 66 очей від 62 пацієнтів, 35 жінок і 27 чоловіків, віком від 19 до 84 років. У всіх хворих була певна форма НВ рогівки. Метою цього дослідження було оцінити антиангіогенний ефект субкон’юнктивального та місцевого застосування бевацизумабу при кількох захворюваннях, пов’язаних з неоваскуляризацією рогівки.
Пацієнти були розподілені на групи А та Б за способом застосування бевацизумабу. Пацієнти групи А отримали одноразову ін’єкцію 0,2-0,5 мл бевацизумабу субкон’юнктивально за допомогою інсулінового шприца після застосування очних крапель для місцевої анестезії (оксибупрокаїн 0,4%, тетракаїн 0,1%) протягом 15 хвилин. Концентрація розчину бевацизумабу, використаного для групи А, становила 25 мг/мл. Група А налічувала 28 очей від 27 пацієнтів, 17 жінок і 10 чоловіків, із середнім віком 60 років (27-84). Пацієнти групи В застосовували очні краплі бевацизумаб двічі на день протягом двох тижнів. Концентрація розчину бевацизумабу, використаного для групи B, становила 2,5 мг/мл. Група B налічувала 38 очей від 35 пацієнтів, 18 жінок і 17 чоловіків, із середнім віком 63,5 року (19-79). Мінімальний термін спостереження становив шість місяців.
Далі пацієнтів було розподілено на 4 підгрупи відповідно до основної причини НВ рогівки. 1 підгрупа – хворі на птеригіум; 2 підгрупа – пацієнти з НВ на донорському диску після наскрізної кератопластики; 3 підгрупа – хворі з іншою очною патологією (лейкома рогівки після опіків лугом, васкуляризовані рубці після виразок рогівки, НВ після герпетичного кератиту та синдром Стівенса-Джонсона або НВ рогівки іншої етіології); 4 підгрупа – пацієнти, які готуються до наскрізної кератопластики високого ризику (табл. 1). Пацієнти підгрупи 4 мали менший термін спостереження через те, що операція була проведена максимум через 3 місяці після лікування. Ці пацієнти були виключені із загальної статистики.
Таблиця 1
Розподіл пацієнтів на групи А і Б та 1, 2, 3, 4 підгрупи
|
|
|
Група А |
Група В |
|
1 |
Птеригіум |
6 |
12 |
|
2 |
НВ після наскрізної кератопластики |
8 |
6 |
|
3 |
Опік лугом |
3 |
1 |
|
Васкуляризований рубець після виразки рогівки |
3 |
2 |
|
|
НВ після герпетичного кератиту |
1 |
2 |
|
|
Синдром Стівенса-Джонсона |
2 |
1 |
|
|
Інша етіологія |
4 |
9 |
|
|
4 |
Підготовка до наскрізної кератопластики |
1 |
5 |
Перед початком лікування всім пацієнтам проводили стандартне офтальмологічне обстеження переднього та заднього відділів ока за допомогою щілинної лампи. Вимірювали скориговану гостроту зору вдалину (СГЗВ) і внутрішньоочний тиск. Контрольні обстеження проводили в обох групах на першому, третьому та шостому місяцях після початку лікування. Зміни неоваскуляризації рогівки документувалися на цифрових фотографіях під час кожного візиту (SONY DXC-950P, кольорова відеокамера 3CCD, Японія).
Ми використовували спеціальний шаблон для оцінки ступеня та зміни НВ рогівки. Ці деталі були додані до цифрової фотографії рогівки кожного пацієнта (мал. 1). Загальний діаметр малюнка становив 12 мм із центральною зоною 6 мм. Він складався з 96 трикутних сегментів однакового розміру, 72 периферичних сегментів (ПС) і 24 центральних сегментів (ЦС). Ступінь НВ рогівки виражали кількістю сегментів, що містять кровоносні судини. Оцінювали кількість сегментів рогівки, уражених НВ, СГЗВ, а також частоту ускладнень і суб’єктивних скарг, пов’язаних з лікуванням. Оцінку фотографій проводив один лікар.
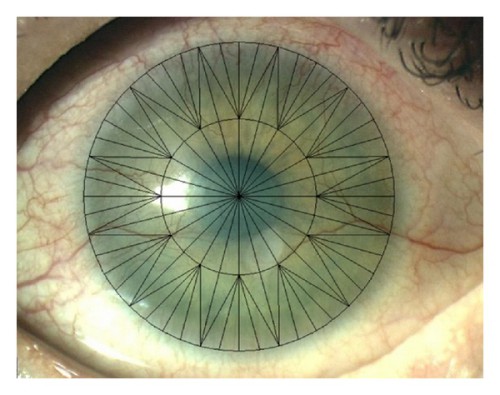
Малюнок 1. Шаблон для оцінки неоваскуляризації рогівки
Кожен пацієнт отримував принаймні одне застосування речовини. Повторне лікування не було показано через місяць після першого застосування бевацизумабу. Ми вирішили повторити лікування у разі позитивної відповіді на перше застосування, щоб досягти подальшої регресії НВ, або рецидиву НВ рогівки.
Використовуючи програму SPSS Statistics (версія 19.0; SPSS, Inc., Чикаго, Іллінойс, США), з метою статистичного аналізу було виконано односторонній дисперсійний аналіз. Значення нижче 0,05 вважалося статистично значущим.
3. Результати
3.1. Субкон’юнктивальна ін’єкція бевацизумабу: група A
Середня кількість уражених периферичних сегментів і центральних сегментів до початку лікування в групі А становила 30,37 (±23,40) – 42,18 % і 4,26 (±5,92) – 17,75 % відповідно. Середня скоригована гострота зору вдалину (СГЗВ) до лікування становила 0,26 (±0,35). Через місяць після першої субкон’юнктивальної ін’єкції бевацизумабу середня кількість уражених периферичних сегментів і центральних сегментів зменшилася до 25,65 (±20,4)–35,63% (Р=0.003) і 3,42 (±5,44)–14,25% (Р=0.001) відповідно. Середня кількість повторних ін’єкцій бевацизумабу в групі А становила 2,07 (1-4). Через шість місяців після початку лікування середня кількість периферичних сегментів і центральних сегментів становила 23,81 (±17,80)–33,07% (Р=0.000) і 3,85 (±5,92)–16,04% (Р=0.000) відповідно. Отримане середнє значення СГЗВ становило 0,28 (±0,36). Результати окремих підгруп підсумовані в таблиці 2 та на рисунку 4.
Таблиця 2
Результати окремих підгруп групи А до та через 6 місяців після початку лікування; середня кількість уражених периферичних (ПС) і центральних сегментів (ЦС) неоваскуляризації; скоригована гострота зору вдалину (СГЗВ)
|
|
Перед лікуванням |
Через 6 місяців після лікування (1 місяць у 4 групі) |
Р |
|||||
|
|
СГЗВ |
ПС |
ЦС |
СГЗВ |
ПС |
ЦС |
Р |
|
|
1 |
Птеригіум (n = 6) |
0,85 (±0,21) |
8,5 (±5,12) |
0 |
0,9 (±0,18) |
6,66 (±4,49) |
0 |
ПС: 0,03 ЦС: 0,2 |
|
2 |
НВ після наскрізної кератопластики (n = 8) |
0,02 (±0,04) |
41,25 (±17,42) |
1,75 (±1,78) |
0,05 (±0,08) |
30,5 (±11,37) |
1,25 (±1,45) |
ПС: 0,001 ЦС: 0,02 |
|
3 |
Інші етіології (n = 13) |
0,14 (±0,17) |
33,77 (±25,16) |
7,76 (±6,76) |
0,16 (±0,21) |
27,61 (±19,78) |
7,23 (±6,99) |
ПС: 0,000 ЦС: 0,002 |
|
4 |
Підготовка до наскрізної кератопластики (n = 1) |
0,0001 |
14 |
0 |
0,001 |
7 |
0 |
|
Кількість сегментів, уражених неоваскуляризацією рогівки під час одномісячного та шестимісячного спостереження, порівняно з кількістю сегментів до лікування, була статистично значно нижчою.
Практично всі пацієнти перенесли ін’єкцію без скарг, за винятком пацієнтів, які перенесли хімічний опік. Пацієнти з хімічним опіком повідомили, що субкон’юнктивальна ін’єкція була дуже болючою навіть після повторного застосування анестезійних очних крапель (оксибупрокаїн 0,4%, тетракаїн 0,1%).
Ми не помітили прогресування НВ одразу після ін’єкції у жодного з пацієнтів у групі А. Ми спостерігали прогресування НВ на трьох очах після початкової регресії. Після подальших ін’єкцій бевацизумабу в усіх трьох очах НВ знову знизився. На малюнку 2 показано НВ рогівки у пацієнта, який отримував субкон’юнктивальний бевацизумаб.
3.2. Місцеве застосування бевацизумабу: група B
Середня кількість уражених периферичних сегментів і центральних сегментів до початку лікування в групі Б становила 27,94 (±20,29) – 38,81% і 2,97 (±4,88) – 12,38% відповідно. Середня скоригована гострота зору вдалину (СГЗВ) до лікування становила 0,55 (±0,42). Через місяць після місцевого застосування розчину бевацизумабу середня кількість уражених периферичних сегментів і центральних сегментів зменшилася до 24,5 (±19,3)–34,07% (Р=0.000) і 1,97 (±3,59)–8,2% (Р=0.000) відповідно. Середня кількість повторного місцевого застосування бевацизумаба у групі B становила 1,16 (1-2). Через шість місяців після початку лікування середня кількість периферичних сегментів і центральних сегментів становила 21,60 (±18,21)–30% (Р=0.000) і 1,84 (±3,79)–7,67% (Р=0.000) відповідно. Отримане середнє значення СГЗВ становило 0,57 (±0,41). Результати окремих підгруп підсумовані в таблиці 3 та на рисунку 5. Статистичний аналіз показує значні відмінності між результатами при спостереженні через один і шість місяців порівняно з кількістю уражених сегментів до початку лікування.
Таблиця 3
Результати окремих підгруп групи Б до та через півроку після початку лікування; середня кількість уражених периферичних (ПС) і центральних сегментів (ЦС) неоваскуляризації; скоригована гострота зору вдалину (СГЗВ)
|
|
Перед лікуванням |
Через 6 місяців після лікування (1 місяць у 4 групі) |
Р |
|||||
|
|
СГЗВ |
ПС |
ЦС |
СГЗВ |
ПС |
ЦС |
Р |
|
|
1 |
Птеригіум (n = 12) |
1,0 (±0,02) |
12,75 (±9,91) |
0,25 (±0,82) |
1,0 (±0,02) |
9,0 (±4,08) |
0 |
ПС: 0,003 ЦС: 0,000 |
|
2 |
НВ після наскрізної кератопластики (n = 6) |
0,06 (±0,04) |
35,5 (±20,13) |
0,83 (±1,21) |
0,12 (±0,13) |
28,0 (±23,12) |
0,33 (±0,74) |
ПС: 0,002 ЦС: 0,000 |
|
3 |
Інші етіології (n = 15) |
0,58 (±0,32) |
37,0 (±21,49) |
3,4 (±4,01) |
0,59 (±0,32) |
29,53 (±18,73) |
2,53 (±3,98) |
ПС: 0,000 ЦС: 0,000 |
|
4 |
Підготовка до наскрізної кератопластики (n = 5) |
0,05 (±0,07) |
28,2 (±12,37) |
10,8 (±6,65) |
0,05 (±0,08) |
20,40 (±14,25) |
6,0 (±5,62) |
ПС: 0,02 ЦС: 0,001 |
Ми помітили прогресування НВ відразу після місцевого лікування в одного пацієнта з НВ після герпетичної виразки рогівки. Через місяць після припинення місцевого лікування НВ різко знизилась порівняно зі станом до лікування. На шести очах ми повторили лікування через три місяці після початку через повторне прогресування НВ рогівки. У всіх хворих підгрупи В1 (птеригіум) спостерігалося значне покращення суб’єктивних скарг: свербіж, відчуття присутності стороннього тіла, косметично неприємне почервоніння ока.
4. Ускладнення
Лише в одного пацієнта групи А виявлено системне ускладнення, що проявилося через 12 годин після субкон’юнктивальної ін’єкції загальною слабкістю, головним болем, парестезією верхніх кінцівок. Ці симптоми виправлялися самі собою без будь-якого втручання, і ми оцінили їх як панічну реакцію пацієнта на лікування. Завдяки чудовій місцевій відповіді пацієнта на лікування ми вирішили продовжити лікування субкон’юнктивальними ін’єкціями бевацизумабу. Подальші звернення пройшли без ускладнень. Що стосується місцевих ускладнень, ми спостерігали дрібні епітеліальні дефекти рогівки у трьох пацієнтів в обох групах А і В. Дефекти повністю загоїлися після форсованої терапії лубрикантами. Реакції гіперчутливості ми виявили у двох пацієнтів групи Б. В обох випадках ця реакція з’явилася на третій день після початку лікування. Вона проявлялася набряком повік і гіперемією кон’юнктиви з папілярною реакцією. Протягом двох днів цей стан був купований в обох випадках шляхом припинення застосування очних крапель бевацизумаб і заміни їх фторметолоном ацетатом. У цих двох випадках ми не вказали подальше лікування очними краплями бевацизумаб.
5. Обговорення
Найсучасніші знання щодо розуміння механізму НВ ока призвели до визначення нових фармакологічних цілей. Оскільки VEGF відіграє вирішальну роль у створенні НВ рогівки, його лікування антитілами проти VEGF є правильним методом [7, 16, 17]. На цю тему вже вийшло кілька публікацій. Як субкон’юнктивальні ін’єкції [18, 19], так і місцеве застосування бевацизумабу [20-23] експериментально використовувалися з багатонадійними результатами в лікуванні герпетичного кератиту [24, 25], рецидивуючого птеригіуму [23, 26], відторгнення трансплантата рогівки [19] і синдрому Стівенса-Джонсона [27]. Публікації стосувалися здебільшого невеликих груп пацієнтів, що не пройшли єдиної схеми лікування. Деякі автори повідомили про чудові ефекти анти-VEGF-антитіла бевацизумабу щодо інгібіції та регресії НВ рогівки [18, 22, 24, 27]. Не спостерігалося регресу васкуляризації рогівки у 2-х дослідженнях, що включали випадки рецидиву птеригіума та відторгнення трансплантата рогівки після наскрізної кератопластики [28, 29]. Інші дослідження довели певний ступінь регресії судин з ураженої рогівки [19, 23, 30]. Ускладнення були описані лише в кількох дослідженнях, і завжди як поверхнева епітелопатія, крихітні дефекти епітелію або прогресування витончення рогівки [22]. Причиною цих несприятливих ефектів може бути той факт, що VEGF підтримує ріст нервових волокон, а його блокування знижує репарацію нервів рогівки [31].
У нашій серії ми спостерігали поліпшення відразу після початку лікування у більшості пацієнтів і стабілізацію результатів у всіх пацієнтів протягом мінімум трьох місяців (рис. 2 і 3). Лікування з використанням антитіла до VEGF бевацизумабу дало статистично значущі результати. У всіх пацієнтів ми спостерігали або покращення, або стабілізацію неоваскуляризації рогівки. В обох групах середня гострота зору під час останньої перевірки покращилася порівняно з початковою. Якщо був рецидив, ми призначали ще одне застосування бевацизумабу. Завдяки цій схемі ми успішно позбавили скарг всіх пацієнтів, які спостерігалися, протягом тривалого часу. Згідно з окремими випадками з більш тривалим спостереженням (до 15 місяців) і середньою кількістю повторних процедур в обох досліджуваних групах, ефект місцевого лікування видається більш стабільним, без необхідності повторного лікування. Оскільки дослідження не було порівняльним, необхідно підтвердити гіпотезу шляхом порівняльного дослідження в більшій групі пацієнтів.
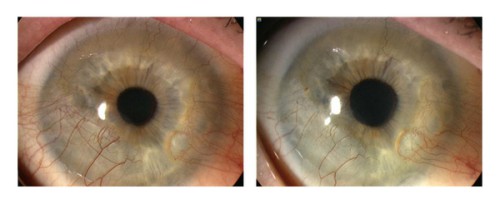
Малюнок 2. Типовий випадок неоваскуляризації рогівки під час лікування субкон’юнктивальною ін’єкцією бевацизумабу. Пацієнтка 63 років з хронічним кератокон'юнктивітом і ревматоїдним артритом. Ліва фотографія показує кругову (360 градусів) неоваскуляризацію (НВ) рогівки (ліворуч). Через шість місяців після субкон’юнктивального лікування бевацизумабом НВ значно знизилась (праворуч)
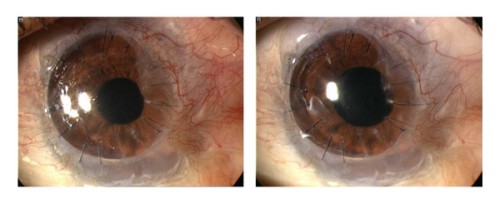
Малюнок 3. Показовий випадок неоваскуляризації рогівки під час лікування місцевим бевацизумабом. Пацієнтом був 19-річний хлопець, який переніс наскрізну кератопластику в поєднанні з трансплантацією аутологічних лімбальних стовбурових клітин з приводу лейкоми рогівки після опіку лугом. Ліва фотографія показує активну неоваскуляризацію (НВ), що досягає донорського трансплантата (ліворуч). Через три місяці після місцевого лікування бевацизумабом НВ зменшилась та утримується на межі трансплантата рогівки (праворуч)
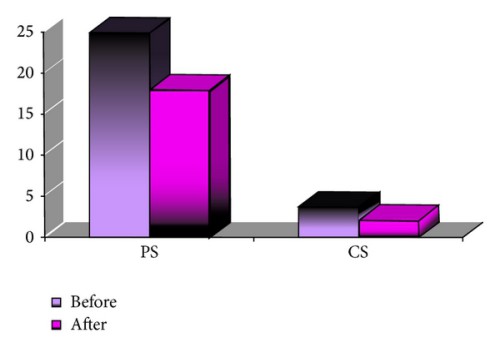
Малюнок 4. Порівняння уражених периферичних (PS) і центральних (CS) сегментів до і після лікування в групі А
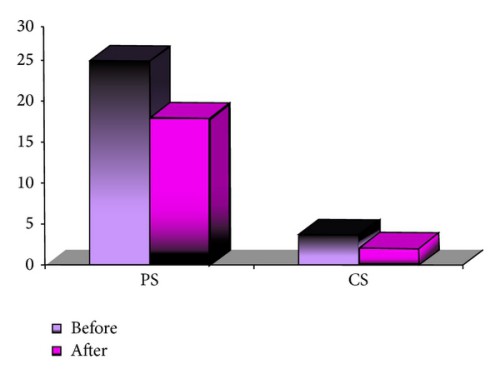
Малюнок 5. Порівняння уражених периферичних (PS) і центральних (CS) сегментів до та після лікування в групі B
На підставі результатів нашого дослідження ми переконані, що використання бевацизумабу в лікуванні активної неоваскуляризації рогівки може бути корисним. Це також може бути корисним при кератопластиці високого ризику, щодо передопераційної підготовки та післяопераційного догляду. Завдяки антитілам проти VEGF кровоносні судини, що можуть призвести до відторгнення трансплантата рогівки, утримуються за межею трансплантата рогівки. Наш досвід показав, що застосування бевацизумабу сприяє комплексному лікуванню птеригіуму, зменшуючи суб’єктивні скарги та відкладаючи хірургічне втручання. Хоча в деяких випадках повторне лікування було необхідним через тимчасове погіршення місцевих результатів, повторне лікування призвело до покращення.
Однак лікування НВ рогівки антитілом бевацизумабом проти VEGF має певні обмеження. Це лише симптоматичне лікування НВ рогівки, що не усуває причину захворювання, та в деяких випадках необхідно повторити лікування, щоб підтримувати його позитивний ефект протягом певного періоду часу. Крім того, його вплив на глибоку васкуляризацію нижчий, на відміну від поверхневої та активної васкуляризації, при якій спостерігається чітка регресія.
Іншим можливим обмежувальним чинником є той факт, що антитіла проти VEGF впливають лише на одну групу ангіогенних агентів. Зрозуміло, що підтримка безсудинної рогівки є активним процесом, який вимагає точного балансу між ангіогенними та антиангіогенними механізмами [7]. Застосування інших антиангіогенних чинників або інгібіторів ангіогенності було досліджено за допомогою in vitro та експериментальних досліджень на тваринах. Наприклад, використання антитіл проти PDGF є чудовою додатковою терапією для антитіл проти VEGF або сильного антиангіогенного чинника PEDF [32].
6. Висновок
Застосування бевацизумабу є ефективним і безпечним методом лікування неоваскуляризації рогівки як у субкон’юнктивальній, так і місцевій формі. Мінімальна частота ускладнень і негативних побічних ефектів обіцяє майбутню еволюцію лікування, а також його впровадження в широку клінічну практику. Необхідні інші клінічні дослідження, щоб оцінити ефективність, дозування та безпеку препарату в кожному випадку неоваскуляризації рогівки.
References
- Arnold, “Experimentelle Untersuchungen uber die Entwicklung,” Virchows Archiv für Pathologische Anatomie und Physiologie und für Klinische Medizin, vol. 54, pp. 1–30, 1872.View at: Google Scholar
- T. Azar, “Corneal angiogenic privilege: angiogenic and antiangiogenic factors in corneal avascularity, vasculogenesis, and wound healing (an American ophthalmological society thesis),” Transactions of the American Ophthalmological Society, vol. 104, pp. 264–302, 2006.View at: Google Scholar
- Chang, E. E. Gabison, T. Kato, and D. T. Azar, “Corneal neovascularization,” Current Opinion in Ophthalmology, vol. 12, no. 4, pp. 242–249, 2001.View at: Publisher Site| Google Scholar
- K. Ambati, E. Patterson, P. Jani et al., “Soluble vascular endothelial growth factor receptor-1 contributes to the corneal antiangiogenic barrier,” The British Journal of Ophthalmology, vol. 91, no. 4, pp. 505–508, 2007.View at: Google Scholar
- Bock, J. Onderka, T. Dietrich, B. Bachmann, B. Pytowski, and C. Cursiefen, “Blockade of VEGFR3-signalling specifically inhibits lymphangiogenesis in inflammatory corneal neovascularisation,” Graefe's Archive for Clinical and Experimental Ophthalmology, vol. 246, no. 1, pp. 115–119, 2008.View at: Publisher Site| Google Scholar
- Cursiefen, “Immune privilege and angiogenic privilege of the cornea,” Chemical Immunology and Allergy, vol. 92, pp. 50–57, 2007.View at: Publisher Site| Google Scholar
- Cursiefen and F. Kruse, “New aspects of angiogenesis in the cornea,” in Essentials in Ophthalmology, pp. 83–99, 2006.View at: Google Scholar
- Qazi, S. Maddula, and B. K. Ambati, “Mediators of ocular angiogenesis,” Journal of Genetics, vol. 88, no. 4, pp. 495–515, 2009.View at: Publisher Site| Google Scholar
- Cursiefen, L. Chen, M. Saint-Geniez et al., “NoНВascular VEGF receptor 3 expression by corneal epithelium maintains avascularity and vision,” Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no. 30, pp. 11405–11410, 2006.View at: Publisher Site| Google Scholar
- Ellenberg, D. T. Azar, J. A. Hallak et al., “Novel aspects of corneal angiogenic and lymphangiogenic privilege,” Progress in Retinal and Eye Research, vol. 29, no. 3, pp. 208–248, 2010.View at: Publisher Site| Google Scholar
- K. Ambati, M. Nozaki, N. Singh et al., “Corneal avascularity is due to soluble VEGF receptor-1,” Nature, vol. 443, no. 7114, pp. 993–997, 2006.View at: Publisher Site| Google Scholar
- Folkman, “History of angiogenesis,” in Angiogenesis: An Integrative Approach from Science to Medicine, W. D. Figg and J. Folkman, Eds., pp. 1–14, Springer, New York, NY, USA, 2008.View at: Google Scholar
- H. Chang, N. K. Garg, E. Lunde, K. Y. Han, S. Jain, and D. T. Azar, “Corneal neovascularization: an anti-VEGF therapy review,” Survey of Ophthalmology, vol. 57, no. 5, pp. 415–429, 2012.View at: Publisher Site| Google Scholar
- Cheng, M. H. Dastjerdi, G. Ferrari et al., “Short-term topical bevacizumab in the treatment of stable corneal neovascularization,” The American Journal of Ophthalmology, vol. 154, no. 6, pp. 940–958, 2012.View at: Publisher Site| Google Scholar
- F. Spaide, K. Laud, H. F. Fine et al., “Intravitreal bevacizumab treatment of choroidal neovascularization secondary to age-related macular degeneration,” Retina, vol. 26, no. 4, pp. 383–390, 2006.View at: Publisher Site| Google Scholar
- Bock, J. Onderka, T. Dietrich et al., “Bevacizumab as a potent inhibitor of inflammatory corneal angiogenesis and lymphangiogenesis,” IНВestigative Ophthalmology and Visual Science, vol. 48, no. 6, pp. 2545–2552, 2007.View at: Publisher Site| Google Scholar
- Papathanassious, S. Theodoropoulou, A. Analitis, A. Tzonou, and P. G. Theodossiadis, “Vascular endothelial growth factor inhibitors for treatment of corneal neovascularization: a meta-analysis,” Cornea, vol. 32, no. 4, pp. 435–444, 2013.View at: Publisher Site| Google Scholar
- P. Doctor, P. V. Bhat, and C. S. Foster, “Subconjunctival bevacizumab for corneal neovascularization,” Cornea, vol. 27, no. 9, pp. 992–995, 2008.View at: Publisher Site| Google Scholar
- Gerten, “Bevacizumab (avastin) and argon laser to treat neovascularization in corneal transplant surgery,” Cornea, vol. 27, no. 10, pp. 1195–1199, 2008.View at: Publisher Site| Google Scholar
- Bock, Y. König, F. Kruse, M. Baier, and C. Cursiefen, “Bevacizumab (avastin) eye drops inhibit corneal neovascularization,” Graefe's Archive for Clinical and Experimental Ophthalmology, vol. 246, no. 2, pp. 281–284, 2008.View at: Publisher Site| Google Scholar
- Jae, K. Dong, K. Eun-Soon, J. K. Myoung, and T. Hungwon, “Topically administered bevacizumab had longer standing anti-angiogenic effect than subconjunctivally injected bevacizumab in rat corneal neovascularization,” International Journal of Ophthalmology, vol. 6, no. 5, pp. 588–591, 2013.View at: Google Scholar
- W. Kim, B. J. Ha, E. K. Kim, H. Tchah, and T. I. Kim, “The effect of topical bevacizumab on corneal neovascularization,” Ophthalmology, vol. 115, no. 6, pp. e33–e38, 2008.View at: Publisher Site| Google Scholar
- C. Wu, H. K. Kuo, M. H. Tai, and S. J. Shin, “Topical bevacizumab eyedrops for limbal-conjunctival neovascularization in impending recurrent pterygium,” Cornea, vol. 28, no. 1, pp. 103–104, 2009.View at: Publisher Site| Google Scholar
- A. Carrasco, “Subconjunctival bevacizumab for corneal neovascularization in herpetic stromal keratitis,” Cornea, vol. 27, no. 6, pp. 743–745, 2008.View at: Google Scholar
- Zheng, S. Deshpande, S. Lee, N. Ferrara, and B. T. Rouse, “Contribution of vascular endothelial growth factor in the neovascularization process during the pathogenesis of herpetic stromal keratitis,” Journal of Virology, vol. 75, no. 20, pp. 9828–9835, 2001.View at: Publisher Site| Google Scholar
- Jin, M. Guan, J. Sima et al., “Decreased pigment epithelium-derived factor and increased vascular endothelial growth factor levels in pterygia,” Cornea, vol. 22, no. 5, pp. 473–477, 2003.View at: Publisher Site| Google Scholar
- S. Uy, P. S. Chan, and R. E. Ang, “Topical bevacizumab and ocular surface neovascularization in patients with Stevens-Johnson syndrome,” Cornea, vol. 27, no. 1, pp. 70–73, 2008.View at: Google Scholar
- Bahar, I. Kaiserman, P. McAllum, D. Rootman, and A. Slomovic, “Subconjunctival bevacizumab injection for corneal neovascularization in recurrent pterygium,” Current Eye Research, vol. 33, no. 1, pp. 23–28, 2008.View at: Publisher Site| Google Scholar
- E. MacKenzie, W. R. Tucker, and T. R. G. Poole, “Bevacizumab (avastin) for corneal neovascularization-corneal light shield soaked application,” Cornea, vol. 28, no. 2, pp. 246–247, 2009.View at: Publisher Site| Google Scholar
- Yoeruek, F. Ziemssen, S. Henke-Fahle et al., “Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn,” Acta Ophthalmologica, vol. 86, no. 3, pp. 322–328, 2008.View at: Publisher Site| Google Scholar
- Q. Yu, M. Zhang, K. I. Matis, C. Kim, and M. I. Rosenblatt, “Vascular endothelial growth factor mediates corneal nerve repair,” IНВestigative Ophthalmology and Visual Science, vol. 49, no. 9, pp. 3870–3878, 2008.View at: Publisher Site| Google Scholar
- Jo, C. Mailhos, M. Ju et al., “Inhibition of platelet-derived growth factor B signaling enhances the efficacy of anti-vascular endothelial growth factor therapy in multiple models of ocular neovascularization,” The American Journal of Pathology, vol. 168, no. 6, pp. 2036–2053, 2006.View at: Publisher Site| Google Scholar







Коментарі
Завантаження...