Моніторинг прогресування глаукоми за допомогою SAP, електроретинографії (PERG і PHNR) та ОКТ
Інші публікації цього автора
Cvenkel Barbara
Інші публікації цього автора
Sustar Maja
Інші публікації цього автора
Perovšek Darko
Інші публікації цього автора

Моніторинг прогресування глаукоми за допомогою SAP, електроретинографії (PERG і PHNR) та ОКТ
Джерело: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8882567/
Анотація
Мета
Дослідити значення шаблонної електроретинографії (PERG) і фотопічно негативної відповіді (PhNR) у моніторингу глаукоми порівняно зі стандартними клінічними тестами (стандартна автоматизована периметрія (SAP) і клінічна оцінка диска зорового нерва) і структурними вимірами за допомогою OCT у спектральній області.
Методи
Проспективне дослідження включало 32 суб’єкти (32 ока) з очною гіпертензією, підозрою або ранньою глаукомою, за якими проводився моніторинг прогресування за допомогою клінічного обстеження, SAP, PERG, PhNR та OCT протягом принаймні 4 років. Прогресування визначали клінічно за задокументованою зміною диска зорового нерва та/або значним прогресуванням поля зору (аналіз трендів EyeSuite™). В аналіз було включено одне око на пацієнта.
Результати
Під час спостереження 13 очей (40,6%) показали прогресування, тоді як 19 залишалися стабільними. У групі прогресування всі параметри показали значне погіршення з часом, за винятком PhNR, тоді як у стабільній групі лише параметри OCT продемонстрували значне зниження під час останнього візиту. Тенденція зміни з часом за допомогою лінійної регресії була найкрутішою для параметрів OCT. На початковому етапі лише товщина комплексу гангліозних клітин (GCC) і перипапілярного нервового волокна сітківки (pRNFL) істотно розрізняла стабільні та прогресивні очі з площею під кривою ROC 0,72 і 0,71 відповідно. Варіабельність між сеансами для перших двох візитів у стабільній групі була нижчою для ОКТ (% межі узгодження в межах ± 17,4% від середнього для pRNFL і ± 3,6% для товщини GCC), ніж для вимірів ERG (в межах ± 35,9% середнього значення для PERG N95 та ± 59,9% для PhNR). Коефіцієнт варіації для повторних вимірів у стабільній групі становив 11,9% для PERG N95 і 23,6% для PhNR, тоді як він був значно нижчим для всіх вимірів OCT (5,6% для pRNFL і 1,7% для товщини GCC).
Висновки
Хоча PERG і PhNR є чутливими для раннього виявлення глаукоматозного ураження, вони мають обмежену корисність для моніторингу прогресування глаукоми в клінічній практиці, головним чином через високу варіабельність між сеансами. Навпаки, показники OCT демонструють низьку варіабельність між сеансами та можуть мати прогностичну цінність для ранньої дискримінації прогресивних випадків.
Ключові слова: глаукома, моніторинг, оптична когерентна томографія, шаблонна електроретинографія, фотопічна негативна відповідь
Вступ
Моніторинг пацієнтів з глаукомою для виявлення прогресування та визначення швидкості втрати функції зору є основою лікування глаукоми. У клінічних умовах рекомендовані тести для моніторингу включають тонометрію, клінічне обстеження диска зорового нерва та шару нервових волокон сітківки (RNFL), а також перевірку поля зору. Оцінка структурних змін доповнюється кількісним вимірам за допомогою оптичної когерентної томографії (ОКТ). Стандартна автоматизована периметрія (SAP) є еталонним стандартом для оцінки зорової функції при глаукомі [1]. Це суб’єктивний метод, який покладається на співпрацю з пацієнтом, і у деяких пацієнтів спостерігається висока варіабельність середнього відхилення з часом, що зменшує здатність виявити справжню зміну від шуму [2]. Електроретинографія (ERG) є об’єктивним методом, і як патерн ERG (PERG), так і фотопічна негативна відповідь (PhNR) ERG є чутливими маркерами дисфункції гангліозних клітин сітківки (RGC), яка є характерною для глаукоми [3-6].
PERG є мірою електричної активності популяції RGC центральної сітківки (понад 40% від загальної популяції RGC) у відповідь на надпорогові стимули [7]. PhNR адаптованої до світла ERG – це негативна хвиля, яка виникає після b-хвилі у відповідь на короткий спалах. Вона відображає узагальнену активність RGC та їх аксонів [8], та її амплітуда, подібно до PERG, може бути зменшена на ранній стадії захворювань, які вражають найвнутрішню сітківку [5].
Недавня оглядова стаття про клінічну застосовність електрофізіологічних тестів при глаукомі виявила розумну кореляцію між амплітудами та затримкою електрофізіологічних вимірів і рутинних тестів на глаукому, головним чином SAP і OCT [9]. Однак залишається незрозумілим, яка роль цих тестів у ранньому виявленні та моніторингу глаукоми. Вимоги щодо складних протоколів, обладнання та досвідченого персоналу обмежують використання електрофізіології особливими випадками та дослідженнями. У нашому попередньому перехресному дослідженні ми виявили, що пацієнти з підозрою та ранньою глаукомою значно зменшили амплітуди PERG N95 та PhNR порівняно з контрольною групою, що вказує на високу чутливість обох електрофізіологічних заходів для раннього виявлення пошкодження гангліозних клітин [10]. Крім того, в очах із підозрою на глаукому більш значне зниження амплітуди PhNR було пов’язане з невеликими змінами товщини перипапілярного шару нервових волокон сітківки (pRNFL), що може вказувати на прогресування глаукоми [10].
Метою цього дослідження було дослідити значення PERG і PhNR у моніторингу глаукоми порівняно зі стандартними клінічними тестами (оцінка SAP і диска зорового нерва) та структурними вимірами за допомогою ОКТ у спектральній області.
Методи
Це довготривале дослідження було проведено відповідно до принципів Гельсінської декларації та схвалено Національним комітетом з етики, Університетський медичний центр Любляни, Любляна, Словенія (KME 33/11/11). Усі учасники були повністю проінформовані про можливі наслідки протоколу дослідження та підписали свою інформовану згоду перед зарахуванням.
Тридцять два пацієнти з очною гіпертензією (ОГТ), підозрою на глаукому або ранню відкритокутову глаукому були набрані з клініки глаукоми відділення офтальмології Університетського медичного центру Любляни, Словенія. Реєстрація почалася в січні 2012 року, і учасники мали щонайменше 4 роки спостереження. Пацієнти були віком від 25 до 81 року (середній вік ± SD, 59,5 ± 12,0 років), з них 9 чоловіків і 23 жінки. Критеріями включення були гострота зору ≥ 0,8 Снеллена, прозорі оптичні середовища та короткозорість < -5D. Критеріями виключення були лікування місцевими або системними кортикостероїдами, діабет або неврологічні розлади (наприклад, хвороба Паркінсона, розсіяний склероз).
На початковому етапі всі ці пацієнти пройшли повне офтальмологічне обстеження та перевірку полів зору, та їм було поставлено такі діагнози: OHT, що характеризується нелікованим внутрішньоочним тиском (ВОТ) постійно > 21 мм рт. ст. та нормальними диском зорового нерва та полем зору; підозра на глаукому, яка характеризується підозрілою появою диска зорового нерва з нормальним або підозрілим полем зору; або рання глаукома, що характеризується наявністю глаукоматозних змін на диску зорового нерва та відповідною відтворюваною втратою поля зору із середнім дефектом від 2 до 6 дБ. Вигляд глаукоматозного диска зорового нерва включав вогнищеве та/або дифузне витончення нейроретинального краю та асиметрію в екскавації диска зорового нерва між очима > 0,2, яка не була спричинена різницею в розмірі або формі диска зорового нерва [11]. Через велику варіативність зовнішнього вигляду диска зорового нерва у здорових людей (за розміром, формою) немає чітких критеріїв ранніх глаукоматозних змін диска. Тому термін «підозрілий диск зорового нерва» використовувався, коли диски мали ознаки, схожі на глаукоматозні зміни диска зорового нерва, і точний діагноз глаукоми можна встановити лише під час подальшого спостереження [11]. Оцінка диска зорового нерва була проведена консультантом з глаукоми (BC) з використанням вищезазначених критеріїв.
Дефекти поля зору визначалися як три або більше суміжних точок із втратою ≥ 5 дБ або двох або більше точок із втратою ≥ 10 дБ за відсутності інших змін, які могли б пояснити дефект.
Пацієнти з глаукомою та ОНТ високого ризику отримували місцеві гіпотензивні препарати як монотерапію або як комбінацію препаратів, таких як аналоги простагландинів, бета-блокатори, альфа-2 агоністи та інгібітори карбоангідрази.
Після офтальмологічного огляду, виміри ВОТ та перевірки поля зору всім суб’єктам проводили ЕРГ та ОКТ.
Тестування поля зору
Стандартну автоматизовану периметрію (SAP) проводили для всіх пацієнтів, використовуючи периметр Octopus 900 (Haag-Streit AG, Koeniz, Швейцарія) з програмою Dynamic Strategy G2. В оцінці використовувалися лише відтворювані тести з < 20% хибнопозитивних і < 20% хибнонегативних відповідей. Були зареєстровані такі глобальні індекси поля зору: середній дефект (MD) і квадратний корінь дисперсії втрати (sLV). MD є позитивним значенням за допомогою периметрії Octopus і являє собою середню втрату поля зору з усіх місць, тоді як sLV є мірою варіабельності в полі зору та збільшення локальних дефектів.
Електроретинографія
Електроретинографічні відповіді реєстрували за допомогою системи візуального електрофізіологічного тестування Espion (Diagnosys LLC, Littleton, MA, USA). Процедура запису для PERG і PhNR відповідала стандартам і рекомендаціям Міжнародного товариства клінічної електрофізіології зору (ISCEV) [12,13]. Петля HK служила реєстраційним електродом і була розміщена в склепіння нижньої повіки [14]. Електрод порівняння з хлориду срібла розміщували на іпсилатеральній скроні, а електрод заземлення розташовували на лобі. Запис PERG не вимагає розширення зіниці; тому його було записано першим. Це було виявлено за допомогою шахової дошки 0,8° з 99% контрастністю, яка змінювалася 1,8 раза на секунду, яка була представлена на екрані стимулятора електронно-променевої трубки 21,6° X 27,8°. Пацієнти сиділи на відстані 1 м від екранного стимулятора та використовували оптимальну корекцію заломлення під час запису. Сто разів було зібрано для кожного запису та повторено щонайменше двічі. Пізніше зіниці розширювали 1% тропікамідом (мідріацил, алькон) і проводили адаптацію до світла протягом 10 хв. Фотопічні ERG були викликані за допомогою стимулятора Ganzfeld ColorDome (Diagnosys LLC, Літтлтон, Массачусетс, США), використовуючи монохроматичні червоні стимули 2,5 кд/м2 (635 нм) на синьому фоні 10 кд/м2 (470 нм). Частота стимуляції становила 1 Гц, і для кожного запису було зібрано 30 розгорток, які повторювали принаймні тричі. Свіпи, які включали артефакти з амплітудою понад 500 мкВ, автоматично відхилялися під час запису, тоді як свіпи з артефактами низької амплітуди, які впливали на базову лінію або очікувану форму хвилі відповіді до 80 мс після початку стимулу, відхилялися вручну. Середнє значення двох найбільш повторюваних або всіх трьох записів (зібраних із 50-80 розгорток) було взято для подальшого аналізу. Сигнали посилювалися зі смугою пропускання від 0,1 до 500 Гц. Для PERG амплітуду P50 вимірювали від дна N35, тоді як амплітуду N95 вимірювали від піка P50. Для фотопічної ERG амплітуду PhNR вимірювали від базової лінії до негативного дна, який чітко з’являвся після b-хвилі та i-хвилі. Співвідношення між PhNR та амплітудою b-хвилі (PhNR ratio = амплітуда PhNR/амплітуда b-хвилі) також було розраховано та використано для подальшого аналізу.
ОКТ
ОКТ спектральної зони (Topcon 3D OCT-2000; Topcon Inc., Токіо, Японія) проводили після ERG-тесту. Були використані наступні два протоколи сканування: тривимірний (3D) диск розміром 6,0 × 6,0 мм (512 A-сканів на 128 B-сканувань) і 6,0 × 6,0 мм 3D макула (512 A-сканувань на 128 B-сканувань). Комерційне програмне забезпечення виводить графік товщини перипапілярного шару нервових волокон сітківки (pRNFL) із сегментації 3D-сканування диска шляхом центрування кола після отримання сканування. Дані були експортовані програмним забезпеченням і проаналізовані за допомогою алгоритму автоматичної сегментації власника. Були зібрані наступні шари: середня товщина pRNFL, середня товщина шару макулярного нервового волокна (NFL), гангліозних клітин – внутрішнього плексиформного шару (mGCIPL) та комплексу гангліозних клітин (GCC). Приймалися лише скани із якістю зображення > 70.
Спостереження
Пацієнтів обстежували протягом мінімум 4 років із застосуванням ОКТ та електроретинографії щорічно (з інтервалом 11–13 місяців), а клінічне обстеження проводили згідно з рекомендаціями Європейського товариства глаукоми протягом 6–12 місяців. Критерії прогресування глаукоми ґрунтувалися на SAP та/або задокументованих змінах диска зорового нерва/RNFL під час офтальмоскопії порівняно з початковим рівнем (зміна витончення нейроретинального обідка, крововилив у диск). Щоб визначити прогресування поля зору, був проведений аналіз на основі трендів у принаймні шести відтворюваних тестах поля зору за допомогою комерційно доступного програмного забезпечення (EyeSuite Progression Analysis™). Прогресування визначалося як дифузне (MD) та/або локальне (sLV) погіршення при P <1% [15].
Статистичний аналіз
Статистичний аналіз проводився за допомогою статистичного пакету для соціальних наук (SPSS 2013, версія 22; Inc., Чикаго, Іллінойс, США) та Origin 8.0 (OriginLab Corporation, Нортгемптон, США). Дані парних очей, ймовірно, корельовані, тому за замовчуванням в аналіз включено лише праве око. Винятком були пацієнти з прогресуванням в обох очах, для яких аналізувалося око зі швидшою швидкістю прогресування в полі зору. У кількох пацієнтів було включено ліве око через кращий сигнал ERG. Нормальність розподілу залежних змінних перевіряли за допомогою критерію Шапіро-Вілка. Більшість змінних показали нормально розподілені дані. Тому порівняння середніх було проведено за допомогою дисперсійного аналізу (ANOVA) і тесту Dunnett. Тенденції змін у часі для клінічних, електрофізіологічних та OCT параметрів були розраховані шляхом застосування лінії лінійної регресії: y = a + bx до середніх значень кожного параметра з часом. Крутість нахилу вказується параметром b, а параметр a є відрізком, що вказує значення кожного параметра в момент часу 0. Розраховані підібрані лінії порівнювали між стабільною та прогресивною групою за допомогою F-тесту, щоб визначити, чи два набори даних істотно відрізнялися один від одного і виявити відмінності в прогресуванні з часом. Кореляції показників ERG та OCT з індексами поля зору розраховували за допомогою кореляційного тесту Пірсона. Аналіз Бланда–Альтмана використовувався для оцінки варіабельності тесту – повторний тест протягом перших двох візитів у стабільній групі, та 95% довірчі інтервали були побудовані для оцінки точності меж згоди (LoA), як описано Бландом і Альтманом [16]. LoA також розраховувалися як відсоток від середнього значення, щоб дозволити порівнювати результати між сеансами для різних методів [17]. Коефіцієнт варіації був розрахований у стабільній групі як відношення стандартного відхилення до середнього значення для кожного параметра на всіх п’яти відвідуваннях, головним чином для порівняння різниці у варіабельності між методами обстеження (ЕРГ, ОКТ, поле зору). Щоб розрізнити очі з прогресивною та стабільною глаукомою під час першого візиту, були побудовані криві робочих характеристик приймача (ROC) для всіх змінних. Усі статистичні тести були двосторонніми, і значення p < 0,05 вважалося статистично значущим.
Результати
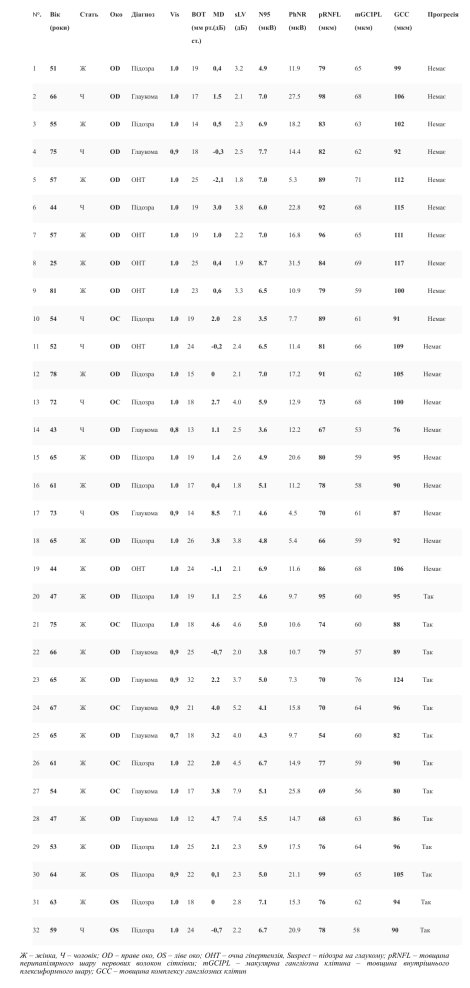
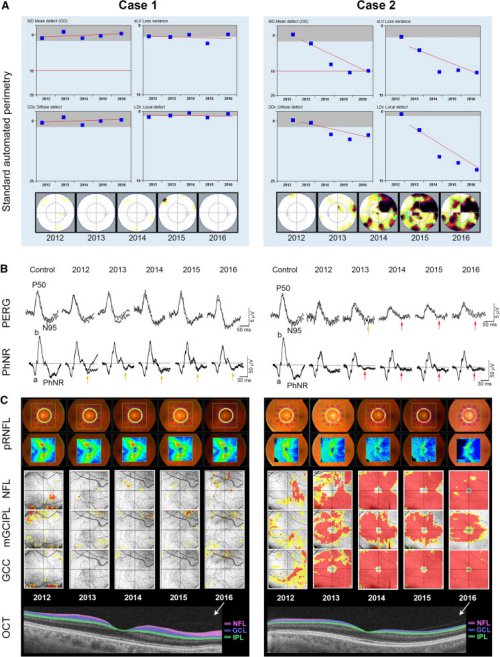
У цьому дослідженні було проаналізовано 32 ока 32 пацієнтів. Відповідно до клінічного вигляду на початковому етапі, ці очі були класифіковані як OHT (6 очей), підозрювана глаукома (16 очей) або рання глаукома (10 очей). Середній термін спостереження становив 52 місяці (SD 4,7 місяця; діапазон 48–64 місяці). Характеристики учасників і клінічні виміри з одного ока на суб'єкта на початковому етапі представлені в (таблиці 1). Під час спостереження у 13 пацієнтів спостерігалося прогресування глаукоми обох очей, а у 19 пацієнтів стан був стабільним. На рис. 1, показані два приклади випадку: випадок 1 око без прогресування в полі зору, товщина PERG, PhNR і pRNFL, і випадок 2 око з прогресуванням глаукоми з ранніми/мінімальними змінами в полі зору (носова сходинка) і товщина pRNFL, але водночас (2013) важливе зниження PhNR і PERG. Під час подальшого спостереження було відмічено значне прогресування SAP та OCT, тоді як аномалія ERG залишалася стабільною.
Таблиця 1
Клінічні характеристики учасників та їх дані вимірів на початку
Результати SAP a, ERG b та OCT c під час контрольних візитів для 2 пацієнтів, Випадок 1 зі стабільною клінічною картиною та Випадок 2 зі швидким прогресуванням, що спостерігалося в усіх проаналізованих показниках. На слідах PhNR жовті стрілки вказують на граничне зниження відповіді, тоді як червоні стрілки вказують на помітну аномалію відповіді
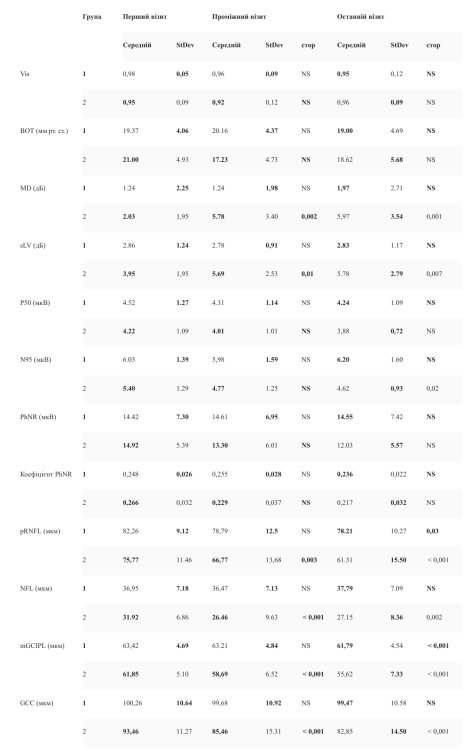
Клінічні виміри (гострота зору, ВОТ, індекси поля зору), параметри ЕРГ (P50, N95, PhNR, співвідношення PhNR) і дані ОКТ на початковому етапі, під час третього, проміжного візиту та під час останнього контрольного візиту для стабільного та прогресивних очей зведено в (таблиці 2). Для стабільної групи всі клінічні та електрофізіологічні параметри, MD, sLV, NFL і GCC товщина залишалися незмінними протягом подальшого спостереження, тоді як для pRNFL і mGCIPL товщини спостерігалося лише під час останнього візиту. У групі прогресування спостерігалося значне погіршення показників MD, sLV, N95 і всіх параметрів OCT, тоді як P50 і PhNR продемонстрували лише незначне, але незначне зниження протягом тривалого періоду спостереження.
Таблиця 2
Порівняння між першим, проміжним (3-м) і останнім (5-м) візитами для клінічних знахідок, показників SAP, ERG і OCT для стабільної (1) і прогресивної (2) групи (дисперсійний аналіз з ретроспективним тестом Даннетта)
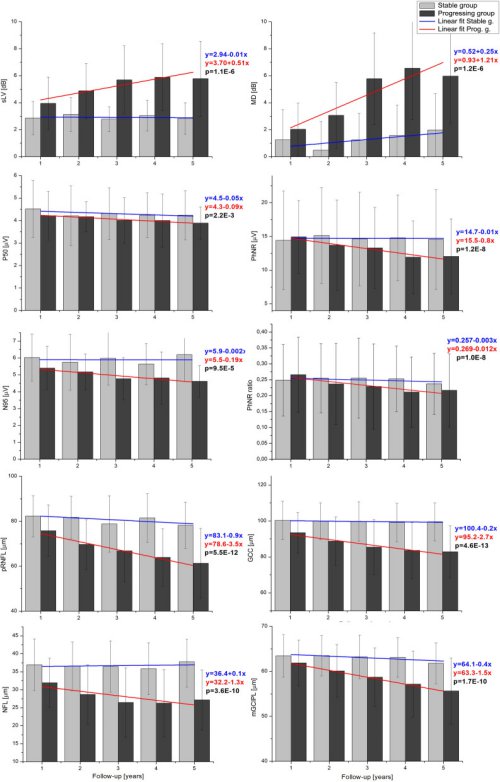
Тенденцію зміни з часом було додатково проаналізовано та порівняно між групами шляхом застосування кривої лінійної регресії до середніх значень кожного параметра під час усіх візитів, як показано на рис. 2. У стабільній групі індекси поля зору, електрофізіологічні показники та параметри ОКТ показали більш-менш горизонтальну підігнану криву. У групі з прогресуванням спостерігався більш крутий нахил підігнаної лінії, що вказувало на погіршення значень індексів поля зору, N95, PhNR, співвідношення PhNR та всіх параметрів OCT. Різниця в нахилах з часом була значущою для всіх параметрів, крім гостроти зору, і була дуже значущою для товщини GCC, pRNFL і mGCIPL.
Середнє значення (± стандартне відхилення) двох показників SAP — середнього дефекту (MD) і квадратного кореня з дисперсії втрат (sLV), показників ERG – амплітуди P50 (P50), амплітуди N95 (N95), амплітуди PhNR (PhNR) і PhNR відношення амплітуд (PhNR ratio) і ОКТ виміри – товщина pRNFL (pRNFL), товщина макулярної NFL (NFL), товщина GCC (GCC) і товщина mGCIPL (mGCIPL) під час контрольних візитів для стабільної та прогресивної групи. Синя та червона лінії лінійної регресії (y = a + bx) вказують на тенденцію змін з часом для стабільних та прогресивних груп відповідно.
Під час першого візиту були виявлені значні помірні кореляції вимірів PERG N95 та OCT з індексами поля зору, з найвищою негативною кореляцією між товщиною pRNFL та MD та sLV (r = -0,50, p = 0,004 та r = -0− 55, P = 0,001 відповідно) (таблиця 3). Під час останнього візиту міцність зв’язку з індексами поля зору зросла більше для параметрів ОКТ (r>0,7, p < 0,001), ніж для N95. Амплітуда PhNR продемонструвала значущу, але помірну кореляцію з MD ( r = -0,35, p = 0,047) (таблиця 3).
Таблиця 3
Кореляція показників ЕРГ та ОКТ з показниками поля зору
|
|
|
Перший візит |
Останній візит |
||
|
MD (дБ) |
sLV (дБ) |
MD (дБ) |
sLV (дБ) |
||
|
P50 (мкВ) |
Pearson Corr |
−0,39 |
−0,30 |
−0,27 |
−0,14 |
|
р |
NS |
NS |
NS |
NS |
|
|
N95 (мкВ) |
Pearson Corr |
−0,44 |
−0,32 |
−0,57 |
−0,44 |
|
р |
0,012 |
NS |
6.14E-04 |
0,012 |
|
|
PhNR (мкВ) |
Pearson Corr |
−0,15 |
−0,08 |
−0,35 |
−0,10 |
|
р |
NS |
NS |
0,046 |
NS |
|
|
Коефіцієнт PhNR |
Pearson Corr |
−0,13 |
0,04 |
−0,37 |
−0,11 |
|
р |
NS |
NS |
0,039 |
NS |
|
|
pRNFL (мкм) |
Pearson Corr |
−0,50 |
−0,55 |
−0,70 |
−0,61 |
|
р |
0,004 |
0,001 |
8.76E-06 |
2.30E-04 |
|
|
NFL (мкм) |
Pearson Corr |
−0,43 |
−0,51 |
−0,73 |
−0,68 |
|
р |
0,013 |
0,00276 |
2.65E-06 |
1.62E-05 |
|
|
mGCIPL (мкм) |
Pearson Corr |
−0,14 |
−0,17 |
−0,49 |
−0,45 |
|
р |
NS |
NS |
0,005 |
0,009 |
|
|
GCC (мкм) |
Pearson Corr |
−0,36 |
−0,42 |
−0,67 |
−0,63 |
|
р |
0,044 |
0,017 |
2.55E-05 |
1.09E-04 |
|
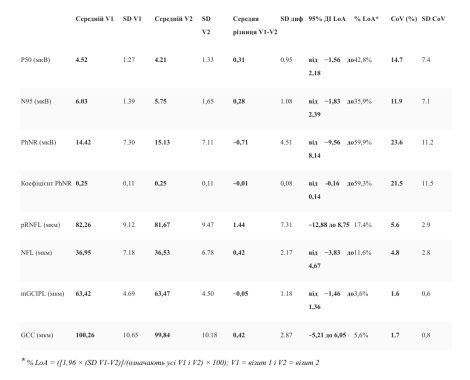
Міжсеансова повторність ERG і OCT для стабільної групи між першим і другим відвідуванням показана як LoA (таблиця 4) і графічно в додатковому файлі (рис. S). ОКТ мав кращу повторність між сеансами з меншим % LoAs (діапазон від 3,6% для mGCIPL до 17,4% для товщини pRNFL), ніж ERG (діапазон від 35,9% для N95 до 59,9% для амплітуди PhNR). В очах без прогресування (стабільна група) коефіцієнт варіації розраховували для повторних вимірів під час першого та наступних візитів, щоб порівняти швидкість варіабельності між сеансами між показниками ERG та OCT (таблиця 4). Показники ERG (N95 і PhNR) показали більшу варіабельність вимірів щодо середнього, ніж показники OCT. Серед вимірів ОКТ коефіцієнт варіації був нижчим для параметрів макули, ніж для товщини pRNFL.
Таблиця 4
Повтореність між сеансами між візитами 1 (V1) і 2 (V2), оцінена за межами узгодження (LoA) і коефіцієнтом варіації (CoV) між усіма 5 візитами для вимірів ERG і OCT на очах без прогресування (n = 19)
Щоб визначити, чи можуть проаналізовані параметри бути чутливими для розрізнення стабільних і прогресивних очей, аналіз ROC був застосований до даних під час першого візиту (таблиця 5). Товщина GCC і pRNFL значно розрізняла прогресивні та непрогресивні очі з площею під кривою ROC 0,72 та 0,71 відповідно. Граничні значення товщини GCC 97,5 мкм мали 63% чутливість і 85% специфічність, тоді як товщина pRNFL 78,5 мкм мала 74% чутливість і 77% специфічність.
Таблиця 5
Площі під кривими ROC на початковому рівні для виявлення прогресування
|
|
AUC |
StErr |
р |
|
ВОТ |
0,42 |
0,10 |
NS |
|
Vis |
0,61 |
0,10 |
NS |
|
MD |
0,36 |
0,10 |
NS |
|
sLV |
0,31 |
0,09 |
NS |
|
P50 |
0,57 |
0,11 |
NS |
|
N95 |
0,65 |
0,11 |
NS |
|
PhNR |
0,47 |
0,11 |
NS |
|
Коефіцієнт PhNR |
0,45 |
0,11 |
NS |
|
pRNFL |
0,71 |
0,10 |
0,046 |
|
NFL |
0,70 |
0,10 |
NS |
|
mGCIPL |
0,64 |
0,10 |
NS |
|
GCC |
0,72 |
0,10 |
0,037 |
Обговорення
Мета цього дослідження полягала в тому, щоб оцінити PERG і PhNR у пацієнтів моніторингу та порівняти показники ERG і структурної ОКТ між прогресуючими та непрогресуючими очима протягом 4-річного спостереження. У стабільній групі спостерігалося значне зменшення товщини pRNFL і mGCIPL лише під час останнього контрольного візиту, тоді як у прогресуючій групі спостерігалося значне погіршення індексів поля зору та параметрів OCT під час проміжного візиту, а також значні зміни для всіх параметрів, за винятком PhNR під час останнього візиту. У прогресуючих очах усі показники (PERG N95, PhNR, RNFL і товщина макули) показали значно крутіші нахили лінійної регресії, які були дуже значущими для товщини pRNFL і GCC. На початковому етапі як показники OCT, так і N95 помірно корелювали з індексами поля зору, тоді як під час останнього візиту сильна кореляція з індексами поля зору була присутня лише для показників OCT. Криві ROC показали, що під час першого візиту товщина pRNFL і GCC були єдиними показниками, які відрізняли прогресуючий від стабільного ока.
Більшість попередніх звітів розглядають PERG та PhNR як об’єктивний метод, який допомагає в ранній діагностиці глаукоми або досліджує кореляцію показників ERG з параметрами поля зору та структурними змінами [3–7,9,10,18,19]. У багатьох дослідженнях глаукоми використовувався PERG у стаціонарному стані, записаний із вищою швидкістю реверсування шаблонного стимулу (зазвичай 16 реверсій на секунду (rps)), що генерує стабільну синусоїдну форму хвилі, період якої відповідає частоті реверсування. PERG у стаціонарному стані відображає в основному пов’язану зі спайком активність ON шляху, тоді як тимчасовий PERG (використаний у нашому дослідженні) отримує майже однакову амплітуду внесків від ON і OFF шляхів з N95, що відображає активність гангліозних клітин, а також активність без спайку P50 [20]. PERG і PhNR є показниками цілісності RGC, і зниження ВОТ в OHT і ранніх глаукомних очах було пов’язане зі збільшенням амплітуд PERG і PhNR , що вказує на поліпшення внутрішньої функції сітківки [21-24]. Очікується, що існує слабка або помірна кореляція електрофізіологічних показників зі структурними параметрами та полем зору, оскільки вони оцінюють різні аспекти патологічного процесу, які не відбуваються одночасно (тобто дисфункція сітківки перед загибеллю клітин) [18,25]. Крім того, PERG і PhNR відображають функцію внутрішньої сітківки (PERG є центральною реакцією, тоді як PhNR є дифузною реакцією всієї сітківки, і тому два тести можуть пропонувати різні рівні інформації) [26], тоді як SAP не представляє тільки активність сітківки, а й діяльність усього зорового шляху. ОКТ вимірює структурні зміни зорового нерва, RNFL і параметри макули, які можуть допомогти клініцисту розрізнити анатомічні зміни у пацієнтів з глаукомою порівняно зі здоровими суб’єктами [27]. Подібно до ЕРГ, діагностична здатність ОКТ є скромною при підозрі на глаукому та покращується із збільшенням тяжкості глаукоми [28,29].
Перехресні дослідження повідомляли про змінну, як правило, слабку або помірну кореляцію між PERG/PhNR і SAP/структурними параметрами [30-34] або навіть відсутність кореляції [25,35]. Різні стадії захворювання (наприклад, OHT, підозра, рання або прогресуюча глаукома) і висока варіабельність амплітуд PERG/PhNR у нормальної популяції можуть пояснити різні знахідки. Ця варіабельність у здорових пацієнтів може вплинути на результати, що пацієнти з глаукоматозним дефектом поля зору все ще можуть мати нормальний PERG [25]. Подібним чином ми виявили значне перекриття амплітуд PERG і PhNR серед пацієнтів з ОГТ, підозрою та ранньою глаукомою на початковому етапі (додатковий файл) і, отже, відсутність або помірну кореляцію PhNR і N95 з параметрами поля зору.
Кілька проспективних досліджень оцінювали здатність електрофізіологічних вимірів передбачати прогресування ОНТ або підозрювану глаукому на очах, використовуючи головним чином PERG у стаціонарному стані [36-39] . Бах та ін. [40] порівняння двох стаціонарних протоколів PERG з однаковою швидкістю реверсування (15 об/с) показало, що протокол PERGLA з використанням шкірних електродів виявляє глаукому подібно до протоколу співвідношення PERG (PERG до двох контрольних розмірів 0,8° та 16°) з використанням рогівки. електроди. Найбільше дослідження, яке включало 120 очей 64 пацієнтів з OHT і середній період спостереження 10,3 року, виявило, що 10% очей перетворилися на глаукому з дефектом поля зору [39]. Співвідношення амплітуди PERG (для стандартних/великих перевірок, що повертаються зі швидкістю 15 обертів за секунду) мало значно крутіший середній від’ємний нахил з часом у тих, хто звернувся, порівняно з пацієнтами, які не перейшли, і у пацієнтів з глаукомою, у яких виявлено 4 роки до зміни поля зору. Коефіцієнт PERG показав площу під кривою ROC 0,75 (чутливість 75%, специфічність 76%) [39]. Вентура та ін. [41] відстежували функцію RGC у пацієнтів із підозрою на глаукому (з нормальним полем зору), використовуючи PERGs для перевірки по черзі зі швидкістю 15 обертів в секунду (парадигма PERGLA) протягом у середньому 5,7 років. Амплітуда PERG показала значний негативний нахил у 15-20% очей з підозрою на глаукому, тоді як значне прогресування SAP-MD було виявлено лише в 0-2% очей. Banitt та ін. [42] оцінювали поздовжні швидкості зміни товщини pRNFL за допомогою амплітуди OCT та PERG у пацієнтів з підозрою на глаукому. Вони виявили, що пацієнти зі значно зниженою початковою амплітудою PERG (≤ 50% від її нормативного значення з поправкою на вік) мали нижчу вихідну товщину RNFL і найшвидшу швидкість витончення RNFL протягом наступних 5 років. У нашому дослідженні під час базового візиту лише товщина pRNFL і GCC істотно відрізняла стабільні очі від прогресуючих. Подібним чином Siesky et al. повідомили, що менша середня товщина RNFL на початку асоціювалася з коротшим часом до прогресування поля зору протягом 5 років спостереження [43]. У недавньому ретроспективному дослідженні, в якому взяли участь 357 осіб із підозрою на глаукому з подальшим спостереженням протягом 5,7 років, швидше зменшення товщини pRNFL (-1,13 ± 0,85 мкм/рік) і mGCIPL (-0,71 ± 0,57 мкм/рік) передбачало розвиток поля зору дефекти [44]. У цьому ж дослідженні швидкість зміни середньої товщини pRNFL (-0,27 ± 0,64 мкм/рік) і GCIPL (-0,19 ± 0,32 мкм/рік) була значною з часом також в очах із підозрою на глаукому, які не виявляли змін поля зору [44]. У нашому дослідженні також було виявлено значне зниження з часом товщини pRNFL і mGCIPL у стабільній групі. Поздовжні та поперечні аналізи показали постійну швидкість приблизно 0,2% на рік стоншування, пов’язаного з віком, у товщині NFL та GCC [45], але на даний момент комерційно доступні алгоритми OCT для моніторингу прогресування не включають стоншення через ефект старіння.
Основною метою нашого дослідження було дослідити роль як ЕРГ, так і ОКТ у моніторингу пацієнтів з глаукомою. У цьому дослідженні середня амплітуда PhNR і N95 показали значний негативний нахил для прогресуючих очей, але показники OCT продемонстрували навіть більш круті лінійні нахили між двома групами і, здається, більш корисні для виявлення прогресування. Крім того, ми зафіксували високу варіабельність вимірів ERG у стабільних очах з часом. Коефіцієнти варіації для групи без прогресування були подібні до тих, що були знайдені іншими [40,46,47]. Ці нормалізовані коефіцієнти варіації (11,9% для N95 і 23,6% для PhNR) були високими порівняно з анатомічними показниками (1,6%-5,6%), що обмежувало їхню чутливість для виявлення змін. Проте певний відсоток варіабельності, виявлений для товщини pRNFL і mGCIPL у стабільній групі, міг бути спричинений справжнім прогресуванням через ефект старіння, оскільки обидва показники ОКТ показали значне потоншення під час останнього контрольного візиту. Крім того, варіабельність/повтореність між сеансами також була розрахована як LoA для перших двох візитів у стабільній групі та показала, що ОКТ мала нижчу варіабельність між сеансами, ніж виміри ERG. Товщина OCT mGCIPL мала найменшу варіацію тест-повторний тест, в межах ± 3,6% від середнього; зміна амплітуди PERG N95 між сеансами була в межах ± 35,9% від середнього значення, а PhNR – у межах 59,9% від середнього значення. Два дослідження повідомили про набагато більшу варіацію для PhNR ± 88,4% і ± 148,3% від середньої амплітуди [17,48].
Одним із обмежень нашого дослідження була невелика кількість змішаних випадків, включаючи пацієнтів з ОНТ, пацієнтів із підозрою на глаукому та пацієнтів із ранньою стадією глаукоми порівняно з проспективними дослідженнями, які включали лише підозру на глаукому. Крім того, медичне лікування було змінено у деяких пацієнтів, щоб досягти зниження внутрішньоочного тиску, що може вплинути на функцію сітківки з потенційним покращенням відповідей ERG [22]. Сильна сторона нашого дослідження полягала в тому, що використовувалися клінічні критерії прогресування: зміна диска зорового нерва та/або погіршення поля зору, підтверджене аналізом трендів.
Хоча існує значна кількість доказів, які підтверджують корисність PERG і PhNR для прогнозування та виявлення раннього глаукоматозного ушкодження, це дослідження показує, що обидва мають обмежену застосовність у моніторингу прогресування глаукоми, головним чином через високу варіабельність між сеансами, що перешкоджає виявленню справжні зміни з часом від шуму. І навпаки, показники ОКТ демонструють низьку варіабельність між сеансами та можуть мати кращу прогностичну цінність для ранньої диференціації прогресуючих випадків у клінічній практиці.
Офтальмологічний центр «АЙЛАЗ» застосовує методику ЕРГ – фотопічний негативний відгук для моніторінгу глаукоми.
References
- (2020) European Glaucoma Society;Terminology and guidelines for glaucoma 5th edition. GECA, Srl, Savona, Italy [PubMed]
- Chauhan BC, Garway-Heath DF, Goni FJ, Rossetti L, Bengtsson B, Viswanathan AC, Heijl A. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2008;92:569–573. doi: 10.1136/bjo.2007.135012. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bach M. Electrophysiological approaches for early detection of glaucoma. Eur J Ophthalmol. 2001;11(Suppl 2):S41–49. doi: 10.1177/112067210101102S05. [PubMed] [CrossRef] [Google Scholar]
- Colotto A, Falsini B, Salgarello T, Iarossi G, Galan ME, Scullica L. Photopic negative response of the human ERG: losses associated with glaucomatous damage. Invest Ophthalmol Vis Sci. 2000;41:2205–2211. [PubMed] [Google Scholar]
- Viswanathan S, Frishman LJ, Robson JG, Walters JW. The photopic negative response of the flash electroretinogram in primary open angle glaucoma. Invest Ophthalmol Vis Sci. 2001;42:514–522. [PubMed] [Google Scholar]
- Preiser D, Lagreze WA, Bach M, Poloschek CM. Photopic negative response versus pattern electroretinogram in early glaucoma. Invest Ophthalmol Vis Sci. 2013;54:1182–1191. doi: 10.1167/iovs.12-11201. [PubMed] [CrossRef] [Google Scholar]
- Ventura LM, Porciatti V. Pattern electroretinogram in glaucoma. Curr Opin Ophthalmol. 2006;17:196–202. doi: 10.1097/01.icu.0000193082.44938.3c. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Viswanathan S, Frishman LJ, Robson JG, Harwerth RS, Smith EL., 3rd The photopic negative response of the macaque electroretinogram: reduction by experimental glaucoma. Invest Ophthalmol Vis Sci. 1999;40:1124–1136. [PubMed] [Google Scholar]
- Senger C, Moreto R, Watanabe SES, Matos AG, Paula JS. Electrophysiology in glaucoma. J Glaucoma. 2020;29:147–153. doi: 10.1097/IJG.0000000000001422. [PubMed] [CrossRef] [Google Scholar]
- Cvenkel B, Sustar M, Perovsek D. Ganglion cell loss in early glaucoma, as assessed by photopic negative response, pattern electroretinogram, and spectral-domain optical coherence tomography. Doc Ophthalmol. 2017;135:17–28. doi: 10.1007/s10633-017-9595-9. [PubMed] [CrossRef] [Google Scholar]
- (2017) European Glaucoma Society Terminology and Guidelines for Glaucoma, 4th Edition - Chapter 2: Classification and terminologySupported by the EGS Foundation: Part 1: Foreword; Introduction; Glossary; Chapter 2 Classification and Terminology. The British journal of ophthalmology 101: 73–127. DOI 10.1136/bjophthalmol-2016-EGSguideline.002 [PMC free article] [PubMed]
- Bach M, Brigell MG, Hawlina M, Holder GE, Johnson MA, McCulloch DL, Meigen T, Viswanathan S. ISCEV standard for clinical pattern electroretinography (PERG): 2012 update. Doc Ophthalmol. 2013;126:1–7. doi: 10.1007/s10633-012-9353-y. [PubMed] [CrossRef] [Google Scholar]
- Frishman L, Sustar M, Kremers J, McAnany JJ, Sarossy M, Tzekov R, Viswanathan S. ISCEV extended protocol for the photopic negative response (PhNR) of the full-field electroretinogram. Doc Ophthalmol. 2018;136:207–211. doi: 10.1007/s10633-018-9638-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hawlina M, Konec B. New noncorneal HK-loop electrode for clinical electroretinography. Doc Ophthalmol. 1992;81:253–259. doi: 10.1007/BF00156014. [PubMed] [CrossRef] [Google Scholar]
- Racette L, Fischer M, Bebie H, Hollo G, Johnson CA, Matsumoto C (2016) Interpretation of visual field progression. In: Haag-Streit AG K, Switzerland (ed) Visual Field Digest 6th Edition; A guide to perimetry and the Octopus perimeter. Haag-Streit AG, Koeniz, Switzerland pp. 165–181.
- Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet. 1986;1:307–310. doi: 10.1016/S0140-6736(86)90837-8. [PubMed] [CrossRef] [Google Scholar]
- Mortlock KE, Binns AM, Aldebasi YH, North RV. Inter-subject, inter-ocular and inter-session repeatability of the photopic negative response of the electroretinogram recorded using DTL and skin electrodes. Doc Ophthalmol. 2010;121:123–134. doi: 10.1007/s10633-010-9239-9. [PubMed] [CrossRef] [Google Scholar]
- North RV, Jones AL, Drasdo N, Wild JM, Morgan JE. Electrophysiological evidence of early functional damage in glaucoma and ocular hypertension. Invest Ophthalmol Vis Sci. 2010;51:1216–1222. doi: 10.1167/iovs.09-3409. [PubMed] [CrossRef] [Google Scholar]
- Salgarello T, Giudiceandrea A, Calandriello L, Marangoni D, Colotto A, Caporossi A, Falsini B. Pattern Electroretinogram Detects Localized Glaucoma Defects. Trans Vis Sci Technol. 2018;7:6. doi: 10.1167/tvst.7.5.6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Luo X, Frishman LJ. Retinal pathway origins of the pattern electroretinogram (PERG) Invest Ophthalmol Vis Sci. 2011;52:8571–8584. doi: 10.1167/iovs.11-8376. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ventura LM, Porciatti V. Restoration of retinal ganglion cell function in early glaucoma after intraocular pressure reduction: a pilot study. Ophthalmology. 2005;112:20–27. doi: 10.1016/j.ophtha.2004.09.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sehi M, Grewal DS, Goodkin ML, Greenfield DS. Reversal of retinal ganglion cell dysfunction after surgical reduction of intraocular pressure. Ophthalmology. 2010;117:2329–2336. doi: 10.1016/j.ophtha.2010.08.049. [PubMed] [CrossRef] [Google Scholar]
- Niyadurupola N, Luu CD, Nguyen DQ, Geddes K, Tan GX, Wong CC, Tran T, Coote MA, Crowston JG. Intraocular pressure lowering is associated with an increase in the photopic negative response (PhNR) amplitude in glaucoma and ocular hypertensive eyes. Invest Ophthalmol Vis Sci. 2013;54:1913–1919. doi: 10.1167/iovs.12-10869. [PubMed] [CrossRef] [Google Scholar]
- Karaskiewicz J, Penkala K, Mularczyk M, Lubinski W. Evaluation of retinal ganglion cell function after intraocular pressure reduction measured by pattern electroretinogram in patients with primary open-angle glaucoma. Doc Ophthalmol. 2017;134:89–97. doi: 10.1007/s10633-017-9575-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hood DC, Xu L, Thienprasiddhi P, Greenstein VC, Odel JG, Grippo TM, Liebmann JM, Ritch R. The pattern electroretinogram in glaucoma patients with confirmed visual field deficits. Invest Ophthalmol Vis Sci. 2005;46:2411–2418. doi: 10.1167/iovs.05-0238. [PubMed] [CrossRef] [Google Scholar]
- Machida S. Clinical applications of the photopic negative response to optic nerve and retinal diseases. J Ophthalmol. 2012;2012:397178. doi: 10.1155/2012/397178. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chen TC, Hoguet A, Junk AK, Nouri-Mahdavi K, Radhakrishnan S, Takusagawa HL, Chen PP. Spectral-domain OCT: helping the clinician diagnose glaucoma: a report by the american academy of ophthalmology. Ophthalmology. 2018;125:1817–1827. doi: 10.1016/j.ophtha.2018.05.008. [PubMed] [CrossRef] [Google Scholar]
- Michelessi M, Lucenteforte E, Oddone F, Brazzelli M, Parravano M, Franchi S, Ng SM, Virgili G (2015) Optic nerve head and fibre layer imaging for diagnosing glaucoma. Cochrane Database Syst Rev: CD008803 DOI 10.1002/14651858.CD008803.pub2 [PMC free article] [PubMed]
- Virgili G, Michelessi M, Cook J, Boachie C, Burr J, Banister K, Garway-Heath DF, Bourne RRA, Asorey Garcia A, Ramsay CR, Azuara-Blanco A. Diagnostic accuracy of optical coherence tomography for diagnosing glaucoma: secondary analyses of the GATE study. Br J Ophthalmol. 2017 doi: 10.1136/bjophthalmol-2017-310642. [PubMed] [CrossRef] [Google Scholar]
- Garway-Heath DF, Holder GE, Fitzke FW, Hitchings RA. Relationship between electrophysiological, psychophysical, and anatomical measurements in glaucoma. Invest Ophthalmol Vis Sci. 2002;43:2213–2220. [PubMed] [Google Scholar]
- Bowd C, Tafreshi A, Zangwill LM, Medeiros FA, Sample PA, Weinreb RN. Pattern electroretinogram association with spectral domain-OCT structural measurements in glaucoma. Eye (Lond) 2011;25:224–232. doi: 10.1038/eye.2010.203. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Park K, Kim J, Lee J. Measurement of macular structure-function relationships using spectral domain-optical coherence tomography (SD-OCT) and pattern electroretinograms (PERG) PLoS ONE. 2017;12:e0178004. doi: 10.1371/journal.pone.0178004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Machida S, Gotoh Y, Toba Y, Ohtaki A, Kaneko M, Kurosaka D. Correlation between photopic negative response and retinal nerve fiber layer thickness and optic disc topography in glaucomatous eyes. Invest Ophthalmol Vis Sci. 2008;49:2201–2207. doi: 10.1167/iovs.07-0887. [PubMed] [CrossRef] [Google Scholar]
- Elgohary AM, Elbedewy HA, Saad HA, Eid TM. Pattern electroretinogram changes in patients with primary open-angle glaucoma in correlation with visual field and optical coherence tomography changes. Eur J Ophthalmol. 2020;30:1362–1369. doi: 10.1177/1120672119872606. [PubMed] [CrossRef] [Google Scholar]
- Falsini B, Marangoni D, Salgarello T, Stifano G, Montrone L, Campagna F, Aliberti S, Balestrazzi E, Colotto A. Structure-function relationship in ocular hypertension and glaucoma: interindividual and interocular analysis by OCT and pattern ERG. Graefes Arch Clin Exp Ophthalmol. 2008;246:1153–1162. doi: 10.1007/s00417-008-0808-5. [PubMed] [CrossRef] [Google Scholar]
- Arai M, Yoshimura N, Sakaue H, Chihara E, Honda Y. A 3-year follow-up study of ocular hypertension by pattern electroretinogram. Ophthalmologica. 1993;207:187–195. doi: 10.1159/000310431. [PubMed] [CrossRef] [Google Scholar]
- Pfeiffer N, Tillmon B, Bach M. Predictive value of the pattern electroretinogram in high-risk ocular hypertension. Invest Ophthalmol Vis Sci. 1993;34:1710–1715. [PubMed] [Google Scholar]
- Bach M, Unsoeld AS, Philippin H, Staubach F, Maier P, Walter HS, Bomer TG, Funk J. Pattern ERG as an early glaucoma indicator in ocular hypertension: a long-term, prospective study. Invest Ophthalmol Vis Sci. 2006;47:4881–4887. doi: 10.1167/iovs.05-0875. [PubMed] [CrossRef] [Google Scholar]
- Bode SF, Jehle T, Bach M. Pattern electroretinogram in glaucoma suspects: new findings from a longitudinal study. Invest Ophthalmol Vis Sci. 2011;52:4300–4306. doi: 10.1167/iovs.10-6381. [PubMed] [CrossRef] [Google Scholar]
- Bach M, Ramharter-Sereinig A. Pattern electroretinogram to detect glaucoma: comparing the PERGLA and the PERG Ratio protocols. Doc Ophthalmol. 2013;127:227–238. doi: 10.1007/s10633-013-9412-z. [PubMed] [CrossRef] [Google Scholar]
- Ventura LM, Golubev I, Feuer WJ, Porciatti V. Pattern electroretinogram progression in glaucoma suspects. J Glaucoma. 2013;22:219–225. doi: 10.1097/IJG.0b013e318237c89f. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Banitt MR, Ventura LM, Feuer WJ, Savatovsky E, Luna G, Shif O, Bosse B, Porciatti V. Progressive loss of retinal ganglion cell function precedes structural loss by several years in glaucoma suspects. Invest Ophthalmol Vis Sci. 2013;54:2346–2352. doi: 10.1167/iovs.12-11026. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Siesky B, Wentz SM, Januleviciene I, Kim DH, Burgett KM, Verticchio Vercellin AC, Rowe LW, Eckert GJ, Harris A. Baseline structural characteristics of the optic nerve head and retinal nerve fiber layer are associated with progressive visual field loss in patients with open-angle glaucoma. PLoS ONE. 2020;15:e0236819. doi: 10.1371/journal.pone.0236819. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shin JW, Sung KR, Song MK. Ganglion cell-inner plexiform layer and retinal nerve fiber layer changes in glaucoma suspects enable prediction of glaucoma development. Am J Ophthalmol. 2020;210:26–34. doi: 10.1016/j.ajo.2019.11.002. [PubMed] [CrossRef] [Google Scholar]
- Zhang X, Francis BA, Dastiridou A, Chopra V, Tan O, Varma R, Greenfield DS, Schuman JS, Huang D, Advanced Imaging for Glaucoma Study G (2016) Longitudinal and Cross-Sectional Analyses of Age Effects on Retinal Nerve Fiber Layer and Ganglion Cell Complex Thickness by Fourier-Domain OCT. Translational vision science & technology 5: 1 DOI 10.1167/tvst.5.2.1 [PMC free article] [PubMed]
- Otto T, Bach M. Retest variability and diurnal effects in the pattern electroretinogram. Doc Ophthalmol. 1996;92:311–323. doi: 10.1007/BF02584085. [PubMed] [CrossRef] [Google Scholar]
- Fortune B, Bui BV, Cull G, Wang L, Cioffi GA. Inter-ocular and inter-session reliability of the electroretinogram photopic negative response (PhNR) in non-human primates. Exp Eye Res. 2004;78:83–93. doi: 10.1016/j.exer.2003.09.013. [PubMed] [CrossRef] [Google Scholar]
- Tang J, Edwards T, Crowston JG, Sarossy M. The test-retest reliability of the photopic negative response (PhNR) Trans Vision Sci Technol. 2014;3:1. doi: 10.1167/tvst.3.6.1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]







Коментарі
Завантаження...