Новини
FDA схвалює Susvimo для лікування діабетичного макулярного набряку (ДМН)
Інші публікації цього автора
FDA схвалює Susvimo для лікування діабетичного макулярного набряку (ДМН)
Джерело: https://eyewire.news/news/fda-approves-susvimo-for-diabetic-macular-edema-dme
FDA схвалило очний імплантат Genentech Susvimo (ранібізумаб) 100 мг/мл для лікування діабетичного макулярного набряку (ДМН). Схвалення робить Susvimo першим і єдиним схваленим FDA лікуванням, що показано для підтримки зору у людей з ДМН за допомогою меншої кількості процедур, ніж стандартні ін’єкції для очей.
Susvimo тепер комерційно доступний у США. Висвітлення схвалення EyewireTV можна знайти тут.
«Susvimo представляє унікальну, зручну альтернативу звичайним очним ін’єкціям для людей із потенційно сліпучим діабетичним станом очей», – сказав у пресрелізі компанії Леві Гарравей, доктор медичних наук, головний медичний працівник і керівник глобального розвитку продуктів. – «Оскільки глобальна поширеність цього захворювання продовжує зростати, сьогоднішнє схвалення FDA для Susvimo відображає нашу відданість інноваціям і покращенню досвіду пацієнтів».
Рішення FDA ґрунтувалося на позитивних однорічних результатах 3-ї фази дослідження Pagoda, які показали, що Susvimo продемонстрував стійке покращення зору у людей з ДМН, причому безпека відповідала відомому профілю безпеки Susvimo. У Pagoda особи з ДМН, які отримували Susvimo, поповнюваний кожні 6 місяців, досягли не меншого покращення зору порівняно з тими, хто отримував щомісяця 0,5 мг ранібізумабу в склоподібне тіло (9,6 літери у таблиці очей, порівняно з 9,4 літерами відповідно).
Susvimo забезпечує постійне доставлення індивідуальної форми ранібізумабу через платформу доставлення порту. У 2021 році FDA вперше схвалила Susvimo для лікування вологої вікової макулярної дегенерації (ВМД).
Genentech заявила, що пропонує програми допомоги пацієнтам через Genentech Access Solutions. Додаткову інформацію можна отримати за номером (866) 4ACCESS/(866) 422-2377 або https://www.Genentech-Access.com.
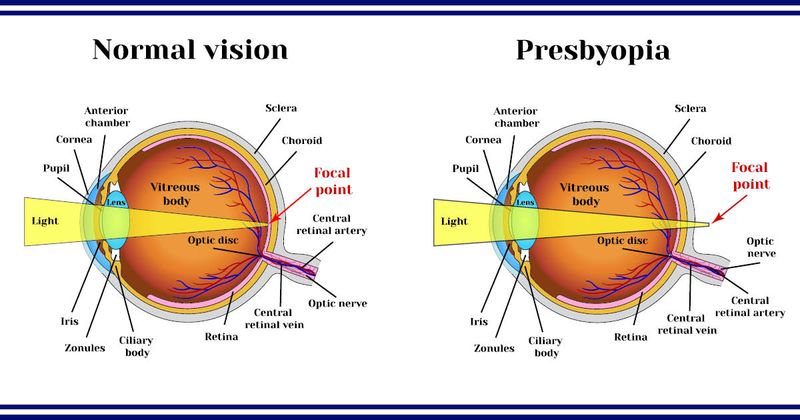
Завершено набір у фазу 3 дослідження комбінованої медикаментозної терапії пресбіопії Visus
Інші публікації цього автора
Schiffman Rhett

Інші публікації цього автора

Завершено набір у фазу 3 дослідження комбінованої медикаментозної терапії пресбіопії Visus
Основні висновки:
- компанія VisusTherapeutics завершила набір у дослідження BRIO-I, що вивчає безпеку та ефективність препарату Бримохол ПФ для лікування пресбіопії;
- результати дослідження очікуються наприкінці цього року;
- компанія Visus Therapeutics завершила набір пацієнтів у ключове дослідження 3 фази препарату Brimochol PF для лікування пресбіопії.
«Очікується, що Brimohol PF змінить тактику лікування пресбіопії, потенційно дозволяючи офтальмологам та оптометристам надавати своїм пацієнтам очні краплі, які добре переносяться й застосовуються один раз на добу, значно покращують зір поблизу протягом робочого дня та, відповідно, якість життя пацієнтів», - сказав Ретт Шиффман, доктор медичних наук, співзасновник, медичний директор і керівник відділу досліджень та розробок компанії Visus в інтерв’ю Healio/OSN.
Подвійне масковане, рандомізоване, багатоцентрове дослідження BRIO-I оцінюватиме безпеку та ефективність препарату Бримохол ПФ (карбахолу й бримонідину тартрату) в учасників з еметропічною факічною та псевдофакічною пресбіопією, йдеться у пресрелізі. Офтальмологічний розчин без консервантів працює завдяки зменшенню розміру зіниці для покращення зору, дозволяючи лише світловим променям, сфокусованим на сітківці, потрапляти в око.
«BRIO-I – це дослідження з безпеки та ефективності, основною метою якого є оцінка комбінації терапії карбахолом і бримонідину тартратом. Комбінована терапія карбахолу та бримонідину тартрату покращує зір на близькій відстані краще, ніж будь-яка з двох монотерапій, що застосовуються окремо», - зазначає Шиффман у пресрелізі. – «Продемонструвавши цей так званий елементарний внесок у цьому дослідженні, Visus стане першою компанією, яка досягне високої планки схвалення комбінованих препаратів для лікування пресбіопії у ключовому дослідженні 3 фази, що вимагається FDA».
Компанія планує представити результати на зустрічах у другому кварталі.
Топ-новина 2022 року в офтальмології: нейропротекторні ефекти нікотинаміду та пірувату у пацієнтів з глаукомою
Інші публікації цього автора

Топ-новина 2022 року в офтальмології: нейропротекторні ефекти нікотинаміду та пірувату у пацієнтів з глаукомою
За останній рік ми ознайомилися з багатьма чудовими статтями, присвяченими діагностиці та лікуванню пацієнтів з глаукомою. Зокрема, ця чудова стаття Де Мораеса та його колег розглядала «Святий Грааль» терапії глаукоми – запобігання втраті глаукоматозних гангліозних клітин шляхом їх захисту від пошкодження, пов’язаного з тиском. Зокрема, автори зазначили, що «мітохондріальні аномалії можуть бути раннім чинником дисфункції нейронів при глаукомі». Вони посилалися на дослідження за участю спеціальної закодованої DBA/2J мишачої моделі з очною гіпертензією, в якої пероральне застосування нікотинаміду (амідної форми вітаміну В3 та попередника нікотинамідного аденіндинуклеотиду, ключової молекули в енергетичному й окислювально-відновному метаболізмі) було успішним у запобіганні глаукоматозному пошкодженню, так що в 93% очей у мишачій моделі DBA/2J глаукома не розвинулася. Аналогічно, вони процитували дослідження за участю цієї та інших моделей глаукоми на тваринах, в яких «пероральне приймання пірувату захищало як щурячі, так і мишачі моделі глаукоми від нейродегенерації, причому комбінація нікотинаміду та пірувату була найбільш захисною в мишачій моделі».
На основі щойно описаного дослідження на тваринах автори повідомили про результати ІІ фази рандомізованого подвійного сліпого плацебо-контрольованого клінічного дослідження, в якому 32 пацієнти завершили вивчення висхідних пероральних доз нікотинаміду (1000 мг – 3000 мг) і пірувату (1500 мг – 3000 мг) порівняно з плацебо (рандомізація 2:1). Метою дослідження було «перевірити гіпотезу про те, що комбінація нікотинаміду та пірувату може покращити функцію гангліозних клітин сітківки при глаукомі людини, виміряну за допомогою стандартної автоматизованої периметрії». Основна гіпотеза полягала в тому, що лікування покращить функцію мітохондрій і виробництво енергії, що призведе до покращення виживання гангліозних клітин у цих пацієнтів. Середня тривалість спостереження становила 2,2 (2,0-2,4) місяці. Основні результати та показники лікування базувалися на «кількості локалізацій тесту поля зору, що покращилися за межами нормальної варіабельності в досліджуваному оці; вторинними кінцевими точками були темпи зміни глобальних показників поля зору (середнє відхилення [MD], стандартне відхилення [PSD] та індекс поля зору [VFI])». Серйозних побічних ефектів не спостерігалося.
Автори повідомили, що «кількість поліпшень у тестових точках була значно вищою в групі лікування, ніж у групі плацебо (медіана [IQR], 15 [6-25] проти 7 [6-11]; P = 0,005). Темпи зміни PSD свідчили про покращення при лікуванні порівняно з плацебо (медіана -0,06 проти 0,02 дБ на тиждень; 95% ДІ від 0,02 до 0,24; P = 0,02), але не MD (0,04 проти -0,002 дБ на тиждень; 95% ДІ від -0,27 до 0,09; P = 0,35) або VFI (0,09 проти -0,02% на тиждень; 95% ДІ від -0,53 до 0,36; P = 0,71)».
Автори дійшли висновку, що лікування призвело до «значного короткострокового поліпшення зорової функції, що підтверджує попередні експериментальні дослідження, які вказують на роль цих агентів у нейропротекції у людей з глаукомою та підтверджують необхідність проведення довгострокових досліджень для встановлення їх корисності в уповільненні прогресування захворювання». Дивно, що будь-яку відповідь можна було виявити лише за 2 місяці лікування. Враховуючи потребу в нейропротекторному лікуванні пацієнтів з глаукомою, ці обнадійливі результати вітаються, та ми з нетерпінням очікуватимемо на результати більш довгострокової оцінки.
Джерело: https://www.ajo.com/
Ефективність блокади периферичного трійчастого нерва для лікування хронічного орбітального болю
У цьому одноцентровому ретроспективному дослідженні вивчали довгострокову реакцію на лікування 19 пацієнтів із хронічним орбітальним болем на блокади периферичного трійчастого нерва. Більшість пацієнтів (84,2%), які отримували блокаду периферичного трійчастого нерва, показали значне покращення симптомів протягом середнього періоду спостереження 2,4 року.
Ці результати свідчать про те, що блокада периферичного трійчастого нерва може бути клінічно корисною стратегією лікування багатофакторного хронічного орбітального болю.
Мета
Схарактеризувати хронічний орбітальний біль у пацієнтів, які отримали користь від блокади периферичного трійчастого нерва, та дослідити взаємозв’язок між етіологією й фенотипом болю, та позитивною відповіддю на лікування.
Методи
У цьому одноцентровому ретроспективному описовому дослідженні були відібрані пацієнти, які перенесли блокаду периферичного трійчастого нерва з приводу хронічного орбітального болю з листопада 2016 року по травень 2021 року. Переглянуті дані включали провокаційні чинники, невропатичні симптоми орбітального болю, поєднання ін’єкцій (один анестетик проти комбінації анестетика + дексаметазон) і ступені епітеліопатії рогівки. Основними оцінюваними результатами були відповідь на ін’єкцію, тривалість ефективності ін’єкції та загальна ефективність лікування. Були досліджені зв’язки між підгрупами хронічного орбітального болю, ознаками ін’єкцій та результатами лікування.
Результати
Було включено 19 пацієнтів, які пройшли загалом 94 блокади периферичного трійчастого нерва з приводу хронічного орбітального болю. Протягом середнього періоду спостереження 2,4 року після початкової ін’єкції (діапазон 7 днів – 4,6 року) 16 (84,2%) пацієнтів досягли часткового або повного покращення. Очне чи позаочне походження орбітального болю або наявність нейропатичних сенсорних характеристик не були пов’язані з результатом лікування. Ін’єкції, що містять дексаметазон, мали нижчу позитивну ефективність (відносний ризик, 0,88; 95% ДІ, 0,81-0,97) і не мали статистично значущого зв’язку з пролонгованим ефектом. 29 (50,9%) із 57 ін’єкцій, для яких була зареєстрована тривалість ефекту, викликали відповідь тривалістю понад 6 тижнів.
Висновки
Модуляція аферентної активності за допомогою блокади периферичного трійчастого нерва, що містить анестетик з дексаметазоном або без нього, може бути багатонадійною стратегією лікування хронічного орбітального болю різної етіології та фенотипу.
Оптогенетична терапія частково відновлює зір у пацієнта з пігментним ретинітом
Інші публікації цього автора
Оптогенетична терапія частково відновлює зір у пацієнта з пігментним ретинітом
Дослідники вперше повідомляють про використання оптогенетичного лікування для відновлення часткового зору у пацієнта з пігментним ретинітом (РП).
Планування дослідження
Дослідження фази 1/2a PIONEER є багатоцентровим відкритим нерандомізованим дослідженням з підвищенням дози, що призначене для оцінки безпеки та переносності оптогенетичного лікування. Учасники дослідження з несиндромальним РП отримали одноразову ін’єкцію аденоасоційованого вірусного вектора, що кодує ChrimsonR (GS030-DP), в око, що погано бачить, і світлову стимуляцію за допомогою інженерних окулярів (GS030-MD). Окуляри активували оптогенетично перетворені гангліозні клітини сітківки, проєктуючи світлові імпульси на сітківку в режимі реального часу на основі локальних змін інтенсивності світла.
До кінця 2020 р. лікування отримали 3 когорти з 7 пацієнтів; однак лише один пацієнт зміг виконати всі 15 постін’єкційних тренувань під час пандемії COVID-19. У хворого 58 років до операції гострота зору була обмежена світловідчуттям. Дослідники провели тестування зорових функцій та електроенцефалографічні записи.
Результати
В окулярах пацієнт міг використовувати проліковане око, щоб сприймати, знаходити, рахувати та торкатися різних предметів. За допомогою багатоканальної електроенцефалограми автори виявили зміни коркової активності над зоровою корою, що відповідні за предметну активність. Пацієнт не міг візуально виявити об’єкти до ін’єкцій, незалежно від того, чи був він в окулярах, або після ін’єкцій без окулярів. Внутрішньоочне запалення не відзначено.
Обмеження
Необхідні більші дослідження і більш довгострокові дані, щоб встановити справжні клінічні наслідки й оцінити безпеку та ефективність. У цьому дослідженні повідомляється лише про одного пацієнта, оскільки подальше спостереження за іншими пацієнтами було обмежено через ситуацію, пов’язану з COVID-19.
Клінічне значення
Це чудова та знаменна демонстрація підтверджує концепцію того, що оптогенетична терапія може відновити зорову функцію у пацієнтів, які осліпли через дегенерацію фоторецепторів.
Джерело: https://www.aao.org/editors-choice/optogenetic-therapy-partially-restores-vision-in-p